下列反应的离子方程式正确的是
| A.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O = AlO2ˉ+4NH4+ |
| B.铁与稀盐酸反应:2Fe+6 H+=" 2" Fe3++3H2↑ |
| C.稀硫酸跟氢氧化钡溶液反应: Ba2++ OH-+ H++SO42-=BaSO4↓+H2O |
| D.铜片与氯化铁溶液反应: Cu+2Fe3+= Cu2++2Fe2+ |
下面的排序不正确的是()
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.熔点由高到低:Na>Mg>Al |
| C.硬度由大到小:金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小: NaF> NaCl> NaBr>NaI |
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是( )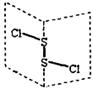
| A.S2Cl2的结构式为Cl-S-S-Cl |
| B.S2Cl2为含有极性键和非极性键的非极性分子 |
| C.S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2 |
| D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
关于氢键的下列说法中不正确的是()
| A.冰中平均每个水分子可形成2个氢键 |
| B.分子间氢键使物质熔点和沸点升高 |
| C.分子间形成氢键可使物质在水中的溶解度增大 |
| D.HF的稳定性很强,是因为其分子间能形成氢键 |
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N N放出942 kJ热量,根据以上信息和数据,下列说法正确的是()
N放出942 kJ热量,根据以上信息和数据,下列说法正确的是()
| A.N4属于一种新型的化合物 |
| B.N4与N2互称为同位素 |
| C.N4化学性质比N2稳定 |
| D.1 mol N4气体转变为N2将放出882 kJ热量 |
关于原子轨道的说法正确的是()
| A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合形成 |
| C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道 |
| D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键 |