一定能在下列溶液中大量共存的离子组是
| A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
| B.碱性溶液:Na+、Ca2+、SO42-、CO32- |
| C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- |
| D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
能使0.1mol/LCH3COONa溶液的pH值增大的方法是
| A.加水 | B.加盐酸 | C.加热 | D.加氯化铵晶体 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
| A.H2+2OH-=2H2O+2e- | B.O2+4H++4e-=2H2O |
| C.H2 -2e-=2H+ | D.O2+2H2O+4e-=4OH- |
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
| A.Ag和AgCl溶液 | B.Ag和AgNO3溶液 |
| C.Fe和AgNO3溶液 | D.Pt和Ag2SO4溶液 |
在Na2S溶液中c(Na+)与c(S2-)的比值是
| A.2 | B.小于2 | C.大于2 | D.1/2 |
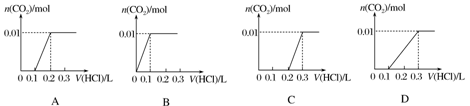
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是