在KClO3+6HCl KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是
KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是
| A.1:6 | B.1:5 | C.6:1 | D.5:1 |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为: 2Li++FeS+2e-=Li2S+Fe有关该电池的下列叙述中,正确的是
A.Li -Al在电池中作为负极材料,该材料中Li的化合价为+1价 -Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
D.充电时,阴极发生的电极反应式为: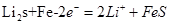 |
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2 mol/L)50mL ,当阴极析出9.6g 固体时,阳极析出的气体在标准状况下的体积是
| A.3.36L | B.2.8L | C.6.72L | D.4.48L |
锌锰干电池在放电时电池总反应方程式可以表示为:Zn+2MnO2+2
 Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是()
Zn2++Mn2O3+2NH3+H2O,在此电池放电时,正极(碳棒)上发生反应的物质是()
A.MnO2和 |
B.Zn2+和 |
C.Zn | D.碳棒 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是()
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
B.电池放电时,负极反应为Fe+2O H--2e-=Fe(OH)2 H--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下列有关化学电池的说法不正确的是( )
| A.化学电池是将化学能变成电能的装置 |
| B.一次电池的活性物质消耗到一定程度就不能使用了 |
| C.二次电池又称充电电池或蓄电池,放电后可以再充电,故可多次重复使用 |
| D.燃料电池是将燃料燃烧所放出的能量转化为化学能装置 |