(1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是(填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式
。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为__________________。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为_______________________________________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是____________________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,CO32-移向电池的
(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3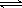 HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是(用离子方程式和必要的文字说明)。
(7分)工业上从海水中提取溴可采用如下方法:
(1)向预先经过酸化的浓缩海水中通入Cl2,将海水的溴化物氧化,反应的离子方程式为:______________________________________。
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,生成NaBr、NaBrO3和CO2,反应的化学方程式为:______________________________________。
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂萃取溴,还可以得到副产品Na2SO4,写出这一变化的离子方程式
__________________________________________。
(4)这样得到的溴中还混有少量Cl2,怎样除去?
_________________________________________________。
(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: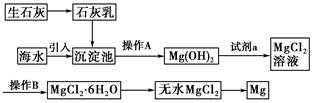
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池发生反应的离子方程式 ________________________________________________________.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________________________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为______________________________________________________________________。
从考虑成本和废物循环利用的角度,副产物氯气可以用于
__________________________________________________________________。
(8分)现有CH4、C2H4、C2H6三种有机物:
(1)等质量的以上三种物质完全燃烧时耗去O2的量最多的是________;生成CO2量最多的是________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)在120 ℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。