实验室中利用下图所示装置制备纳米碳酸钙(1纳米=1×10-9m)(部分夹持装置已略去),向饱和CaCl2溶液中通入NH3和CO2可制得纳米碳酸钙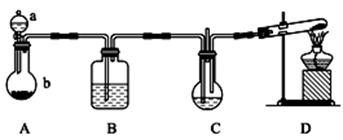
供选择的药品:①石灰石 ②氯化铵 ③氢氧化钙 ④饱和氯化钙溶液 ⑤浓硫酸
⑥6 mol·L-1盐酸 ⑦饱和食盐水 ⑧饱和NaHCO3溶液
(1)装置A中,仪器a的名称是 ,仪器b中应盛放的固体为 。(填药品序号)。装置B 中盛放的溶液是 (填药品序号)。装置D的试管中发生反应的化学方程式为 。
(2)如何判断所得碳酸钙颗粒是否为纳米级。 。
(3)通入适量气体后,C装置中物质恰好完全反应,过滤,所得滤液显 (填“酸”、“碱”、“中”之一)性。
(4)装置C中, 右边的导管并未插入液面,原因是
(5)上述装置存在一处缺陷,该缺陷为 。
(9分)学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)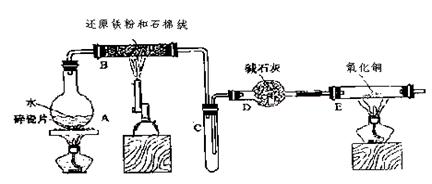
(1)回答下列问题:所用铁粉中若有杂质铝,欲除去不纯铁粉中混有的铝粉可以选用的试剂为__ __(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
此步涉及反应的离子方程式为。经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是___________________。
D装置的作用:________________.
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
①用离子方程式表示步骤I中通入Cl2的作用(并表示电子转移的方向和数目)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填”合理”或”不合理”)。
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_____。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN + NaOH + H2O ="==" NaAlO2+ NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是。
(2)完成以下实验步骤:组装好实验装置,首先,再加入实验药品,接下来的实验操作是,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。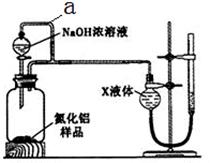
(4)导管a的主要作用是。
(5)为测定生成气体的体积,量气装置中的X液体可以是(填选项序号)。
a.CCl4 b.H2O c.NH4Cl溶液d.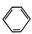
(6)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AIN的质量分数是(用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度:
(7)步骤②生成沉淀的离子方程式为。
(8)若在步骤③中未洗涤,测定结果将(填“偏高”、“偏低”或“无影响”)。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为IA,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接,C接,接F。
(2)写出B电极上发生的电极反应式:;
G试管中淀粉KI溶液变化的现象为,
相应的离子方程式是。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是(选填下列操作步骤的编号)。
①称量电解前电极质量②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极④低温烘干电极后称量
⑤低温烘干刮下的铜后称量⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA=。
(本题共12分)乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
| 物质 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
互溶 |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
完成下列填空:
(1)上图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去。
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用。
使用分水器装置进行回流的可逆反应,一般应具备条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。
预先加水的目的是。
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,
其可能的原因是。
(4)水洗的目的是。碱洗的目的是。
测pH值的操作。
(5)本次实验乙酸正丁酯的产率。