在密闭容器中,对于可逆反应A+3B  2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是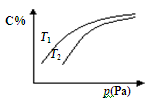
| A.若正反应方向△H <0,则T1> T 2 |
| B.压强增大时,混合气体的密度减小 |
| C.A一定为气体 |
| D.B一定为气体 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g) 2X(g)+Y(l)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
| c(SO2)/mol·L-1 |
1.00 |
0.50 |
0.23 |
3.00×10-37 |
3.00×10-37 |
| c(CO)/mol·L-1 |
4.00 |
3.00 |
2.46 |
2.00 |
2.00 |
下列说法不正确的是
A.X的化学式为CO2
B.前1s内v(X)=" 1.00" mol·L-1·s-1
C.该回收原理运用了SO 2的还原性
D.该温度下,此反应的平衡常数的数值是3.33×1036
下图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是
| X |
Y |
Z |
|
| A |
无水硫酸铜 |
氯气 |
饱和食盐水 |
| B |
碱石灰 |
氨气 |
水 |
| C |
氯化钙 |
二氧化硫 |
氢氧化钠 |
| D |
氯化钙 |
一氧化氮 |
氢氧化钠 |
已知16S和34Se位于同一主族,下列说法正确的是
| A.热稳定性:H2Se>H2S>H2O | B.原子半径:Se>S>Cl |
| C.酸性:H2SeO4>H2SO4>HClO4 | D.还原性:S2-> Se2- >Br- |
下列解释事实的方程式正确的是
A.利用铝热反应焊接钢轨: 2Al + Fe2O3  2Fe + Al2O3 2Fe + Al2O3 |
| B.用氯水除去FeCl3溶液中的Fe2+: Cl2 + Fe2+ ="==" 2Cl- + Fe3+ |
| C.用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H+ + OH- ="==" H2O |
| D.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2Na+ + 2OH- ="==" Na2SiO3 + H2O |
下列说法不正确的是
| A.甲苯和环己烯都能使酸性高锰酸钾溶液褪色 |
| B.用银氨溶液可以鉴别乙醛和葡萄糖溶液 |
| C.甲醛和乙二醇都可作为合成高分子化合物的单体 |
| D.丙烷和2-甲基丙烷的一氯代物均为两种 |