【化学——选修3:物质结构与性质】
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。
金刚石和石墨均为碳的同素异形体,它们在燃烧过程中氧气不足时生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。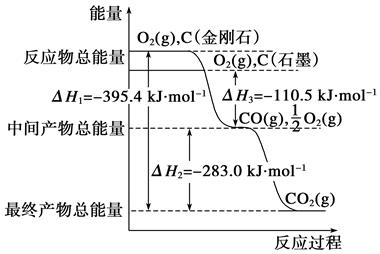
(1)等量金刚石和石墨完全燃烧,(填“金刚石”或“石墨”)放出热量更多,写出表示石墨完全燃烧的热化学方程式:;
(2)在通常状况下,金刚石和石墨,(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式:;
(3)12 g石墨在一定量空气中燃烧生成气体36 g,该过程放出的热量为kJ。
X、Y、Z、R、W五种元素分布在三个不同的短周期,它们的原子序数依次增大。YR2是主要的温室气体,W是短周期中金属性最强的元素。甲是W的最高价氧化物的水化物,乙是X、Z组成的最简单化合物。
(1)Z元素在周期表中位于第周期,第族。
(2)甲含有的化学键有。
(3)比较Y、R、W原子半径的大小:<<(填元素符号)。
(4)一定条件下,X单质和R单质在甲的浓溶液中可以形成燃料电池,该燃料电池的正极的反应式是。
(5)工业上生产乙,若每生成a mol乙时放出b kJ热量,则该反应的热化学方程式为。
根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al
(1)只含有离子键的是(用序号回答,下同)
(2)含有共价键的离子化合物是
(3)属于共价化合物的是
(4)熔融状态能导电的化合物是
(5)熔融状态时和固态时,都能导电的是
化合物D是硅橡胶的稳定剂,其合成路线如下图
(1)B的分子式为; C中官能团名称。
(2)C→D的反应类型为。
(3)B→C的化学方程式为。
(4)化合物D可能具有的性质有(选填序号)。
a.加成反应 b.与FeCl3溶液发生显色反应
c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备 ,反应类型依次是(选填序号)。
,反应类型依次是(选填序号)。
a.加成 、 取代、 消去
b.取代、消去、加成
c.消去、加成、取代
按要求填空:
I.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
①CH3CH2CH2COOH
②
③
④
⑤
⑥
(1)芳香烃:,(2)酯:(3)酚:,(4)醛:,
II.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
(1)2-甲基丁烷和丁烷,
(2)正戊烷和2,2-二甲基丙烷,
(3)对二甲苯和1,4—二甲苯,
(4)1-已烯和环已烷。
III.已知某有机物的结构简式为
(1)该有机物中所含官能团的名称是、。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):。