根据下表提供的数据,下列判断正确的是
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: |
B.常温下,已知酸H2A存在如下平衡: ; ; ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+) |
| D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
下列与化学反应能量变化相关的叙述正 确的是
确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.根据盖斯定律,可计算某些难以直接测定的反应的△H |
| D.同温同压下,H2 (g)+ Cl2 (g) =" 2HCl" (g) 在光照和点燃条件的△H不相同 |
向1LFeBr2溶液中, 通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的
通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的 体积变化不计,则下列说法中正确的是
体积变化不计,则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br一)=0.4mol/L |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)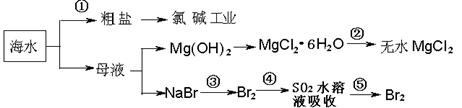
下列有关说法不正确的是
A.从能量转换角度来看,框 图中的氯碱工业是一个将电能转化为化学能量的过程 图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3 + 等杂质,加入的药品顺 + 等杂质,加入的药品顺 序为: 序为: |
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是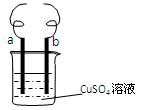
| A.构成原电池时b极反应为: Cu-2e-=Cu2+[ |
| B.构成电解池时a极质量一定减少 |
| C.构成电解池时b 极质量可能减少也可能增加 |
| D.构成的原电池或电解池工作后,会产生大量气体 |
某有机物A(C8H16O2)能发生下图所示的变化,其中C与F是同分异构体。则符合该条件的A的同分异构体有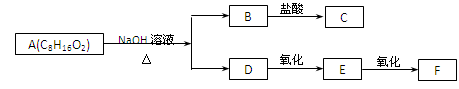
| A.1种 | B.2种 | C.3种 | D.4种 |