已知某溶液中含有下列8种离子中的5种(忽略水的电离及离子的水解):K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且5种离子的物质的量浓度相等。为了进一步探究该水溶液的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.无法确定溶液中是否存在Cu2+离子 |
| B.原溶液中不含K+、Al3+、CO32-等离子 |
| C.根据步骤②只能确定溶液中一定存在NO3-离子 |
| D.步骤③所得到的白色沉淀共有2种钡盐 |
下列事实不能用勒夏特列原理(平衡移动原理)解释的是()
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
⑤钠与氯化钾共融制备钾Na(1)+KC1(1) K(g)+NaC1(1);
K(g)+NaC1(1);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
| A.①②③ | B.②⑥ | C.③④⑤ | D.②⑤⑥ |
10℃时,某化学反应A→C的反应速率vA=0.1mol·L-1·S-1,若温度每升高10℃,反应速率增加到原来的2倍,若要使vA=1.6 mol·L-1·S-1,则反应温度应控制在()
| A.30℃ | B.40℃ | C.50℃ | D.60℃ |
有如下的可逆反应:X(g)+2Y(g)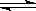 2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是()
2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是()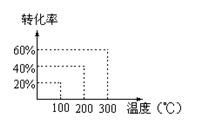
| A.100℃ |
| B.200℃ |
| C.300℃ |
| D.不能确定 |
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应:
A(s)+2B(g) C(g)+D(g)已达平衡的是:()
C(g)+D(g)已达平衡的是:()
| A.混合气体的平均摩尔质量 | B.混合气体的密度 |
| C.A物质的质量 | D.气体的总物质的量 |
已知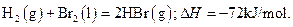 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为()
| A.404 | B.260 | C.230 | D.200 |