在学习过程中,小明同学提出一个问题:“碳燃烧时可能生成CO2,也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?”
[猜想]碳与氧化铜反应生成的气体中:①只有CO2;②既有CO,又有CO2;③只有CO。
[查阅资料]浸有磷钼酸溶液的氯化钯试纸遇CO2无变化,但遇到微量CO会立即变成蓝色。
[方案设计]通过上述资料和已有知识,小明初步设想用浸有磷钼酸溶液的氯化钯试纸和澄清石灰水对碳与氧化铜反应生成的气体进行检验。根据小明的设想,请你填空:
(1)若试纸不变色,澄清石灰水变浑浊,则只有CO2;
(2)若试纸变成蓝色,澄清石灰水变浑浊,则既有CO,又有CO2;
(3)若试纸_____________,澄清石灰水_____________,则只有CO。
[实验验证]经过思考之后,小明设计了下图实验装置:
实验步骤:(1)打开弹簧夹,先通一会儿纯净、干燥的N2;
(2)关闭弹簧夹,点燃酒精灯加热。
[结论]小明通过分析实验现象,确认猜想②是正确的,请你写出装置C中发生反应的化学方程式:_______________ ____________________________;
[反思与评价](1)该实验开始前通一会儿N2的目的是:_______________________;
(2)请从环保的角度分析该实验装置中的不完善之处_____________________________。
请从下列物质中选择适当的试剂,设计不同的方法对锌、铁、铜三种金属的活动性顺序进行探究:
| A.锌片 | B.铁钉 | C.铜片 | D.硫酸铜 |
E.稀硫酸F.硫酸锌 G.硫酸亚铁。
(1)方法一所选用的三种试剂是CuSO4、ZnSO4和______________(填化学式,下同)。
(2)方法二所选用的是四种试剂是Fe、Cu、Zn和___________________。
(3)方法三所选用的三种试剂是_____________________________________。
实验探究:蜡烛刚熄灭时产生的白烟是什么?
提问:蜡烛刚熄灭时,总会有一缕白烟冒出,它的成分是什么呢?我提出如下假设:A白烟是燃烧形成的二氧化碳B 白烟是燃烧形成的水蒸气 C白烟是石蜡蒸汽凝成的石蜡固体
实验1吹灭蜡烛,立即用一个沾有澄清石灰水的烧杯罩住白烟,其目的是为了验证假设。
2吹灭蜡烛,立即用干冷的玻璃片放在白烟上,玻片没有出现水雾,说明白烟不是。
3吹灭蜡烛,立即用燃烧的木条去点白烟,发现蜡烛被重新点燃,说明白烟具有可燃性,这为假设提供了依据,同时又排除了假设 原因是 。
下图是实验室常见的制取气体的装置: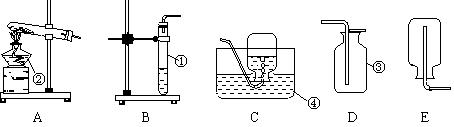
(1)写出仪器名称:①______②________③_______④______ (每空0.5分,其余每空1分)
(2)实验室采用加热高锰酸钾制取氧气时,其试管中应放的药品是_______,试管口还要放一团棉花,目的是______________,该反应的文字表达式是________________________。
(3)用排水法开始收集氧气的适宜时刻是。
(4)以下是实验步骤,将步骤的序号按正确的先后次序排列为。
A点燃酒精灯加热 B检查气密性 C熄灭酒精灯 D向试管中装入药品 E收集气体 F将试管固定在铁架台上 G从水中撤离导管
(5)某同学收集完毕,先停止加热再将导管移出水面,你预测这种操作会引起什么后果______________。
(6)实验室若用双氧水与二氧化锰混合制取氧气,则发生装置选用,收集装置选用。
(7)通常情况下,氨气是一种无色,有刺激性气味的气体,密度比空气小,极易溶于水,实验室用加热氯化铵和碱石灰固体混合物来制取氨气.实验室制取氨气的发生装置,可选用,收集装置应为。(以上都填序号)
实验与探究
(1)小明同学课下自制了如下图的实验装置,对水通电分解进行了实验探究,请你和他一起完成此实验。
①在此试验中往水中加入少量的氢氧化钠溶液的目的是
②b试管内产生的气体是,检验此气体的方法是现象是
③若在正极上产生了20升的气体,则在负极上产生升
写出水电解的反应的文字表达式:,反应的基本类型是
(2)该实验证明了:①
②在化学反应中分子分解成原子,
(3)试用分子原子的观点解释
李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应
的化学方程式为:C+2CuO 2Cu+CO2↑他联想到单质碳的一些化学性质,认为在该实验中还
2Cu+CO2↑他联想到单质碳的一些化学性质,认为在该实验中还
可能会有CO产生。
查阅资料:CO气体能使湿润的黄色氯化钯试纸变蓝色。
实验验证:
(1)当然A处酒精灯,数分钟后发现试管中的黑色固体物质变红,该红色物质是_____;
(2)装置B中发生的实验现象是__________________________,该反应的化学方程式是______________________________________;
(3)C装置中湿润的黄色氯化钯试纸变蓝色,说明有______气体生成,证明李洋同学是判断是正确的。
【实验反思】:正确完成下列2小题的另奖励4分(化学试卷总分不超过60分)。
(4)李洋同学对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO 2Cu+CO2↑中的一种产物和反应物木炭又发生了新的化学反应,产生了CO;
2Cu+CO2↑中的一种产物和反应物木炭又发生了新的化学反应,产生了CO;
③原因三:……
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理:__________________________________________。
(5)在设计装置时还要考虑环保因素,因此要在装置C处添加______________装置。