潍坊电缆厂为增效节支,决定对生产中的废电缆进行回收利用。已知电缆绝缘皮是塑料,线芯是铜。为了回收金属铜,同时得到硫酸亚铁,设计了如下方案: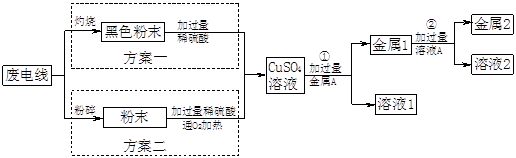
请完成下列问题:
(1)方案中①反应的现象是 ;
反应的化学方程式是 。
(2)纯铜在 (填“金属1”或“金属2”)中。
(3)溶液2中含有的溶质是 。
(4)你认为方案 好,理由是 。
海洋中蕴含丰富的资源.
(1)海水淡化是解决淡水资源不足的重要方法.下列方法中,可以使海水变为淡水的是 (填字母序号).
A.滤纸过滤 B.吸附
C.沉降D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和热传热介质.重水中重氢原子(D)的相对原子质量是2,则重水中氢元素的质量分数为 .
(3)从海水中制备纯碱和金属镁的流程如图所示:
回答下列问题:
①步骤Ⅴ中所加试剂是 .
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下了物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为 (填字序号).
A.适量的盐酸
B.稍过量的Na2CO3溶液
C.稍过量的Ba(OH)2溶液
③第Ⅲ歩反应的化学方程式是 .
④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点是 (写一条).
2014年12月28日,青烟威荣高铁正式通车.
(1)如图1高铁车头的玻璃是用无机玻璃、树脂、塑料等粘合而成,能耐受强大的撞击力.这种玻璃属于 材料.
(2)高铁建设需要消耗大量的铝、铁等金属.
①工业上常用电解氧化铝的方法冶炼金属铝,该反应属于 (填字母序号).
| A.化合反应 | B.分解反应 |
| C.置换反应 | D.复分解反应 |
②某兴趣小组在实验室中利用CO气体模拟炼铁的原理,如图2所示.
Ⅰ.为了避免装置A中玻璃管在加热时可能发生爆炸,加热前应 .
Ⅱ.装置A玻璃管中发生反应的化学反应方程式是 .
Ⅲ.装置B除了吸收CO2气体外,还有 作用
新版《生活饮用水卫生标准》(简称新国标)中水质检测指标从原来的35项增加到106项.对供水各环节的水质提出了相应的要求.
(1)新国标在无机物指标中修订了镉、铅等的限量.这里的镉、铅指的是 (填序号).
| A.原子 | B.分子 |
| C.元素 | D.单质 |
(2)新国标中对水的pH的规定为6.5≤pH≤8.5.实验室用pH试纸测得自来水的pH=8,说明该自来水显 (填“酸”、“碱”或“中”)性.
(3)新国标中消毒剂由1项增至4项,加入了对用臭氧、二氧化氯和氯胺消毒的规定.①臭氧(O3)在消毒过程中转化为氧气.臭氧转化为氧气属于 (填“物理”或者“化学”)变化.②二氧化氯消毒过程中产生的次氯酸根离子(ClO﹣)也有消毒作用.ClO﹣中氯元素的化合价为 价③氯胺(NH2Cl)由 (填数字)种元素组成.用氯胺消毒时,反应的化学方程式是NH2Cl+X=NH3+HClO,其中X的化学式为 .
根据下列装置,结合所学知识回答下列问题:
(1)请写出图中带有标号仪器的名称:① ,② .
(2)实验室用氯酸钾和二氧化锰的混合物制取氧气,所选发生装置是 (填字母),写出此反应的化学方程式: .
(3)若选用E装置收集氧气,气体应从 (填“a”或“b”)端通入.
(4)用上述实验制得的氧气完成F装置所示实验,要在集气瓶底部装少量水或铺一层细沙,其目的是 ,写出F装置中发生反应的化学方程式: .
现有下列仪器,回答有关问题:
(1)仪器C的用途是 .
(2)要配制一定溶质质量分数的硝酸钾溶液.
①从上图选择所需仪器,除E、G外,还需选用的仪器有 (填字母);
②配制的步骤为计算、 、量取、溶解、装入试剂瓶并贴好标签;
③此实验中E的作用是 .