在4L密闭容器中充入6molA(g) 和5molB(g) 在一定温度下发生反应:
3A(g)+B(g)  2C(g)+xD(g),达到平衡时,生成2molC ,测得D的浓度为0.5mol/L,则下列判断正确的是
2C(g)+xD(g),达到平衡时,生成2molC ,测得D的浓度为0.5mol/L,则下列判断正确的是
| A.x=1 |
| B.平衡时A的浓度为1.5 mol/L |
| C.B的转化率为20% |
| D.反应起始和达到平衡时,混合气体的压强比为4:5 |
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是
①a-b=m+n
②元素的原子序数:a>b>c>d
③元素非金属性:Z>R
④最高价氧化物对应水化物碱性:X>Y
| A.②③ | B.只有③ | C.①②③④ | D.①②③ |
X、Y为同主族元素,Y的原子半径大于X。下列说法正确的是(m、n均为正整数)
| A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| B.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| C.若HnY的水溶液为酸性,则HnX的酸性比HnY的酸性更强 |
| D.若Y的最高正价为+7,则X的最高正价一定为+7 |
几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 化合价 |
-1 |
-2 |
+4、-4 |
-1 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/nm |
0.071 |
0.074 |
0.077 |
0.099 |
0.110 |
0.143 |
0.160 |
0.186 |
A.A的单质能将E单质从HE的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
太空服以多种金属和胶黏剂做辅料,其中某种金属R可形成离子R2+。已知该离子的原子核内有n个中子,R原子的质量数为m。则W克该离子共含有的电子为
A.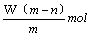 |
B.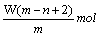 |
C.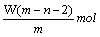 |
D.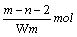 |
在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si。下列说法不正确的是
| A.Li在N2中燃烧生成Li3N | B.LiOH是极易溶的强碱 |
| C.Be(OH)2既能溶于强酸又能溶于强碱溶液 | D.硼酸钠溶液显碱性 |