(1)25℃时,一定浓度的K2Cr2O7溶液中存在下列平衡:Cr2O72-(橙红色)+H2O  2CrO42-(黄色)+2H+K=8.3×10-15,则该反应的平衡常数表达式为
2CrO42-(黄色)+2H+K=8.3×10-15,则该反应的平衡常数表达式为
K=
取少量上述溶液两等份,分别滴加浓硫酸和浓烧碱溶液,出现的现象依次是 ,
(2)已知在T=298K时,反应:2H2O2(l)=2H2O(l)+O2(g) △H =" –196.5" kJ/mol
则该正向反应的△S 0,
令△G=△H-T△S ,判断该正向反应的△G 0 , 自发进行(填“能”或“不能”)
研究表明:过氧化氢酶对上述反应的催化效果最佳,这是由于它能极大地降低该反应的 。
(3)向K2Cr2O7酸性溶液中加入H2O2,能生成深蓝色的过氧化铬CrO(O2)2反应如下:Cr2O72-+4H2O2+2H+=2CrO(O2)2+5H2O
类比于Na2O2,判断:该反应 (填“属于”或“不属于”)氧化还原反应,过氧化铬中铬元素的化合价为
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。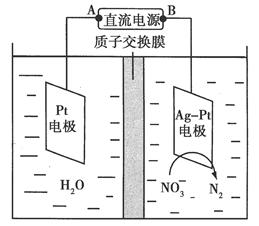
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为________。
②上述反应离子方程式为____________________,其平均反应速率v(NO3-)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法________。
(2)电化学降解NO3-的原理如图所示。
①电源正极为________(填“A”或“B”),阴极反应式为______________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
硫酸铜在工农业生产和生活中都有重要的应用。请回答下列问题:
(1)铜与浓硫酸共热是制备硫酸铜的方法之一,写出反应的化学方程式:__________________。但该反应生成的气体污染环境。为避免环境污染,可在铜粉与稀硫酸的混合物中通入热空气,反应的总化学方程式为____________________。
(2)将铜粉置于稀硫酸中不发生反应,加入双氧水,则铜粉可逐渐溶解。写出反应的离子方程式:____________________。
(3)将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可得到硫酸铜晶体。为了节约原料,H2SO4和HNO3的物质的量之比最佳为________________。
(4)用惰性电极电解硫酸铜溶液,实验装置如图甲所示。图乙是电解过程中产生气体的总体积V与转移电子的物质的量n(e-)的关系图。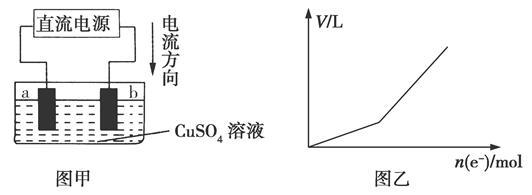
电解过程中,a电极的现象是______________;b电极的电极反应式为____________________。
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________(填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为7865,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。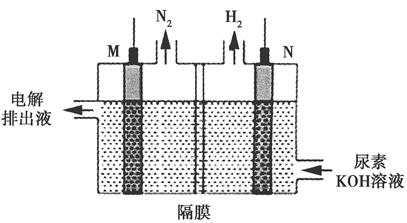
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO3—三种含氯元素的离子,其中ClO-、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
(1)t1前,氧化产物是______________________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式:_____________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是________mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是________(填字母)。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
(5)配平下列离子方程式:________Fe(OH)3+________ClO-+________OH-=________FeO42—+________Cl-+________H2O。
某溶液可能含有Na+、K+、Mg2+、Cu2+等阳离子及MnO4—、SiO32—、AlO2—、CO32—、HCO3—、SO42—、Cl-等阴离子,已知:①该溶液呈无色;②经测定溶液的pH=12;③取少量溶液,加入100 mL 2 mol·L-1稀盐酸进行酸化,有白色沉淀生成,还得到一种无色无味的气体,该气体使澄清石灰水(足量)变浑浊。对酸化后的溶液过滤,得到滤液甲。
(1)由①②③可判断:原溶液中一定不存在的离子是________,一定存在的离子是________。
(2)将滤液甲分成两等份,一份中逐滴加入氨水、最终有白色胶状沉淀,说明原溶液中一定有________(填离子符号),刚开始加入氨水时,没有沉淀产生,原因是____________________________________(用离子方程式表示);另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明原溶液中一定有________(填离子符号),过滤得到滤液乙。
(3)往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5 g,则原溶液中是否有Cl-?________(填“是”或“否”)。