为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是
①饱和的Na2CO3溶液、②饱和的NaHCO3溶液、③浓硫酸、④灼热的铜网、⑤碱石灰
| A.①③④ | B.②③④ | C.②④③ | D.③④⑤ |
在下图的五个烧杯中都盛有天然水:

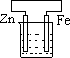


①②③④⑤
铁被腐蚀由快到慢的顺序是
| A.④②①③⑤ | B.③②①④⑤ | C.③②④⑤① | D.④⑤②③① |
已知某强氧化剂[RO(OH)2]2+离子中的元素R可被亚硫酸钠还原到较低价态。若把1.2×10—3 mol [RO(OH)2]2+还原,需要消耗6 mL 0.2 mol/L的亚硫酸钠溶液,则反应后R的化合价为
| A.0 | B.+2 | C.+3 | D.+4 |
下表中第I栏中的化学反应和与第II栏中的化学反应都可以用第III栏中的离子方程式表示的是
| 选项 |
第I栏 |
第II栏 |
第III栏 |
| A |
NaHCO3溶液滴入Ca(OH)2溶液 |
NaHCO3溶液滴入NaOH溶液 |
OH-+HCO3-=CO32-+H2O |
| B |
铝片投入少量NaOH溶液 |
铝片溶液投入过量NaOH溶液 |
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ |
| C |
碳酸钙加入足量稀盐酸 |
碳酸钠加入足量稀盐酸 |
CO32-+2H +=CO2↑+ H2O |
| D |
过量SO2气体通入NaOH溶液 |
少量SO2气体通入NaOH溶液 |
SO2+2OH-= SO32-+ H2O |
把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨做电极进行电解,阳极生成的物质是:
| A.H2 | B.Ag | C.Cl2 | D.O2 |