水溶液X中只可能溶有Na+、K+、Mg2+、Al3+、AlO2—、SiO32—、HCO3—、CO32—、SO42-中的若干种离子。某同学对该溶液进行了如下实验: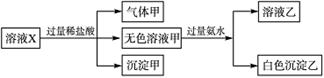
下列判断正确的是
| A.K+、AlO2—和SiO32—一定存在于溶液X中 |
| B.HCO3—和SO42-一定不存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
| D.溶液中一定存在大量CO32— |
现有四种元素的基态原子的电子排布式如下:
①l s2 2s2 2p6 3s2 3p4②l s2 2s2 2p6 3s2 3p3③1s2 2s2 2p3④1 s2 2s2 2p5
则下列有关比较中正确的是 ( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是 ( )
A四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、Ca02、Na2 0、 Na2 02等
C元素A、C简单离子的半径大小关系为A<C
D-元素A、C电负性大小关系为A>C
下列说法正确的是()
| A.含n molHCl的浓盐酸与足量MnO2反应可生成n NA /4 个氯分子() |
B.在密闭容器中建立了N2+3H2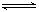 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解 |
| C.同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| D.20 g重水(D2O)中含有的电子数为10NA |
NA代表阿伏加德罗常数,下列说法正确的是()
| A.12.4g白磷含有的P—P键数目为0.4NA |
| B.15.6gNa2O2与过量的CO2反应时,转移的电子数为0.4NA |
| C.标准状况下,a L甲烷和乙烷混合气体中的分子数为a NA /22.4 |
| D.5.6 g铁粉与硝酸完全反应失去的电子数一定为0.3NA |
足量锌投入到1L14mol/L浓硫酸中充分反应,经测定没有硫酸剩余则此过程转移的电子数()
| A.大于14NA | B.等于14NA | C.小于14NA | D.无法确定 |