某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
| |
100mL 盐酸 |
100mL 盐酸 |
100mL 盐酸 |
| m(混合物) |
14.2g |
25g |
27.6g |
| V(CO2) |
3.36L |
4.48L |
4.48L |
A.盐酸的物质的量浓度为3.0mol·L
B.加入混合物14.2g时盐酸不足
C.加入25g混合物时盐酸过量
D.根据表中数据计算出混合物中NaHCO3与KHCO3的物质的量之比是
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: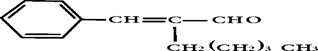
关于茉莉醛的下列叙述错误的是
| A.在加热和催化剂作用下,能被氢气还原 |
| B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与溴发生取代反应 |
| D.不能与氢溴酸发生加成反应 |
下列实验操作方法正确的是
| A.在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 |
| B.测定CuSO4晶体结晶水含量时,当灼烧晶体至全部变为白色粉末后,露置在空气中冷却至室温称取其质量 |
| C.用氢氧化钠溶液清洗盛过苯酚的试管 |
D.向溴乙烷中滴加硝酸酸化的AgNO 3溶液,以检验其中的溴元素 3溶液,以检验其中的溴元素 |
能发生银镜反应,但滴入石蕊试液后不变色,若加入少量NaOH溶液并滴入酚酞试液共煮,则红色消失。这种有机物是
| A.甲酸 | B.乙酸 | C.甲酸甲酯 | D.乙醛 |
既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是
| A.通入足量溴水中 | B.与足量的液溴反应 |
C.在导管中处点燃 |
D.一定条件下与H2反应 |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2C7酸性水溶液乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小
③乙醇有还原性④乙醇是烃的含氧化合物
| A.②④ | B.②③ | C.①③ | D.①④ |