(16分)按要求回答下列问题:
(1)t℃时,已知0.1 mol·L-1HCl溶液中c(OH-)=1×10-11mol·L-1,现将0.2mol·L-1的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH= ;
(2)常温下,0.1 mol·L-1NaHB溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子只有H2O;且c(H+)=0.01 mol·L-1,根据题意回答下列问题:
①该溶液中c(HB-)+c(B2-) = mol·L-1
②写出酸H2B的电离方程式 ﹑ 。
③常温下,0.1 mol·L-1H2B溶液c(H+) 0.11 mol·L-1(填>、< 或 =);
(3)①向0.1 mol/L NaAlO2溶液中加入等体积0.1 mol/L NaHCO3溶液,会产生白色沉淀。据此推断AlO2-和CO32-结合H+能力更强的是 ;
②已知CO32-比ClO-结合H+能力更强,则在次氯酸钠溶液中通入少量CO2的离子反应方程式为: ;
③室温下,等浓度的NaAlO2溶液的pH NaClO溶液的pH(填>、< 或 =)。
(8分)下列物质中 ①稀H2SO4 ②NH3 ③Cu ④乙醇 ⑤NaOH ⑥石墨
⑦NaCl ⑧CuCl2溶液 ⑨NH4Cl ⑩Na2O⑪CO2 ⑫空气
(1)属于混合物的是(填序号,下同)________;(2)属于电解质的是________;
(3)属于非电解质的是________;(4)能导电的是_______;
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
| 实验 序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温度 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
800 ℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
(1)在实验1,反应在0至40分钟时间内A的平均速率为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3v1(填>、=、<=,)800℃时,反应平衡常数=,且C3=mol/L,可推测实验3中隐含的条件是。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为mol/L, B的转化率=。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为mol/L, B的转化率=。
(1)有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
(2)下列装置可防止铁棒被腐蚀的是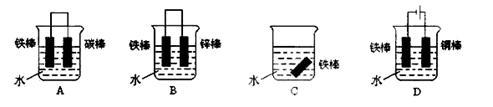
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是(填“吸氧腐蚀”或“析氢腐蚀”)。写出相关的电极反应式:负极,正极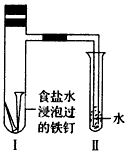
氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.
下列叙述正确的是.
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.若t3时由673K升至773K,则n(H2)将增大 |
| D.t2、t3时刻,n(N2)不相等 |
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)⇌2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
如图为相互串联的甲乙两个电解池,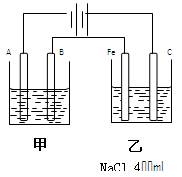
请回答:
(1)甲池若为电解精炼铜的装置,A极是,材料是,电极反应为,B极是,材料是,电极反应为。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为。
(3)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度。