在25℃、100kPa条件下,将15L O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中:V(CO)= ___________L;V(H2)= ___________L。
(2)若剩余气体的体积为a L,求原混合气体中CO和H2的体积比。
(3)若剩余气体的体积为b L,计算b的取值范围。
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。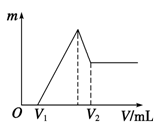
当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1的H2SO4,再加入480 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、 Ag+、 Mg2+、 Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在 ,(填“是”或“否”),若存在求其最小浓度,若不存在说明理由 。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
| A.Na2O2+2HCl=2NaCl+H2O2 |
| B.Ag2O+H2O2=2Ag+O2↑+H2O |
| C.2H2O2=2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填字母代号)。
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出该反应的离子方程式并配平_______________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为 。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
()两种物质都不是电解质
()两种物质都是钠的化合物
()两种物质都是氧化物
()两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色。
①物质M的化学式为______________。
②证明有红褐色胶体生成的实验操作是___________________。