下列变化过程中肯定要放出热量的是
| A.H2→H+H | B.H+Cl→HCl |
| C.H2O(l)→H2O(s) | D.CaCO3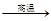 CaO+CO2 CaO+CO2 |
下列物质中既能与强酸发生反应又能与强碱发生氧化还原反应的是
| A.NaHCO3 | B.Mg | C.Al(OH)3 | D.Al |
下列有关物质的用途错误的是
| A.水玻璃用作木材防火剂 | B.高纯度的硅是制造光导纤维的材料 |
| C.可用氢氟酸刻蚀玻璃 | D.氢氧化铝、小苏打可用于治疗胃酸过多症 |
下列说法或叙述中正确的是
| A.硫酸、纯碱、氯酸钾、氧化钠分别属于酸、碱、盐、碱性氧化物 |
| B.将饱和FeCl3溶液滴入NaOH溶液中,加热煮沸,可制得Fe(OH)3胶体 |
| C.反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
| D.氯气的水溶液能导电,因此氯气属于电解质 |
在日常生活中,我们经常看到铁制品生镑、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是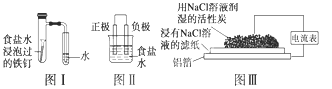
| A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图I所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl-—2e-—Cl2↑ |
| D.图Ⅲ装置的总反应为4A1+302+6H20——4A1(0H)3,生成的Al(OH)3进一步脱水形成白斑 |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+ )>c(C1O-)>c(CH3COO- )>c(OH-)>c(H+) |
| B.碳酸钠溶液中滴加少量氯水的离子方程式:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- |
| C.向0.lmol•L-1CH3COOH 溶液中滴加NaOH 溶液至C(CH3COOH) : C(CH3COO-) =9:5,此时溶液pH = 5 |
| D.向浓度均为1×10 3 mol•L- 的KC1和K2Cr04混合液中滴加1×10 3 mol•L- 的AgN03溶液,CrO42-先形成沉淀 |