下列措施肯定能使化学反应速率增大的是
①增大反应物的量 ②增大压强 ③升高温度 ④使用正催化剂
| A.①②③ | B.③④ | C.②③④ | D.①②③④ |
已知2SO2(g)+O2(g) 2SO3(g);△H= -197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
2SO3(g);△H= -197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
| A.Q2=1/2Q1=98.5 | B.Q2=1/2Q1<98.5 | C.Q2<1/2Q1<98.5 | D.无法确定 |
下列各组离子,在所给条件下一定能大量共存的是
| A.pH="0" 的溶液中:Mg2+、Fe3+、NO3-、SO42- |
| B.能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- |
| C.含有大量Fe3+的溶液:SCN-、I-、K+、Br- |
| D.由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
下列反应的离子方程式正确的是
A.苯酚与碳酸钠溶液的反应: |
| B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O |
| D.淀粉碘化钾溶液在空气中变蓝2I-+O2+2H2O= I2+2OH- |
下列说法不正确的是
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,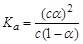 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
CO(g)+1/2O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
在100℃时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
| A.平衡时,体系内含NO2为0.04mol·L-1 |
| B.平衡时,N2O4的转化率为60% |
| C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1 |
| D.在2s时,体系内压强为反应前的1.1倍 |