现有三种元素的基态原子的电子排布式如下:① [Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5。则上述三种原子的第一电离能大小关系正确的是
| A.②>①>③ |
| B.③>①>② |
| C.③>②>① |
| D.①>②>③ |
下列有关物质的性质和该性质的应用均正确的是()
| A.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂 |
| B.浓硫酸具有强氧化性,常温下可用铝罐盛装 |
| C.氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃 |
| D.过氧化钠具有强氧化性,可用作潜水艇中氧气的来源 |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如表所示,下列说法正确的是()
X Y
Z W
| A.非金属性:Z<X<Y |
| B.W的原子序数可能是Y的原子序数的2倍 |
| C.气态氢化物稳定性:Y<W |
| D.四种元素中不可能有金属元素 |
NA表示阿伏加德罗常数的值,下列有关说法正确的是()
| A.标准状况下,22.4 LCH4和CH3CH2OH的混合物所含分子数为NA |
| B.常温常压下,16 g14CH4所含中子数目为8 NA |
| C.0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA |
| D.0.1 L 3 mol•L﹣1的NH4NO3溶液中含有的NH4+数目为0.3NA |
下列物质的工业制备原理不正确的是()
A.氨气:N2+3H2 2NH3 2NH3 |
B.硅:SiO2+2C Si+2CO↑ Si+2CO↑ |
C.乙烯:2C2H5OH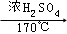 CH2=CH2↑+H2O CH2=CH2↑+H2O |
| D.漂白粉:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O |
德国人弗里茨•哈伯(Fritz Haber)由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量.下列说法中正确的是()
| A.N2和H2在点燃或光照条件下可合成氨 |
| B.氨水显酸性 |
| C.氨气遇到浓盐酸会发生反应产生白烟 |
| D.由氨制取硝酸过程中,氮元素被还原 |