影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)甲同学的实验目的是__________________________________________;要得出正确的实验结论,还需控制的主要实验条件是___________________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。完成该实验应选用的实验药品是______________________;应该测定的实验数据是_____________________________。
实验二:某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:____________________________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:____________________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片纯度、质量、表面积均相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中。
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化。
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中______________________,实验b中________________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(11分)某同学用下图所示装置制取乙烯,请回答: 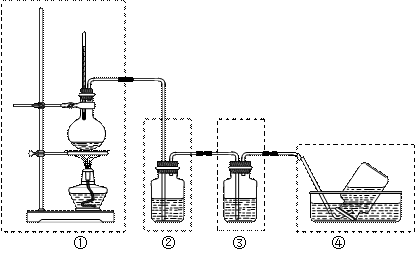
(1)在装置①~③中,有明显错误的一个装置是_____(填序号),改进方法是
。
(2)实验室制取乙烯的化学方程式为,反应类型为。
(3)配制乙醇和浓硫酸混合液的方法是。
(4)若装置②中所盛试剂为氢氧化钠溶液,则其作为。
(5)若装置③中的试剂为溴的四氯化碳溶液,观察到的现象是。
(6)实验前往往在烧瓶中加入一些碎瓷片,目的是_________________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。 ②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
(12分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是__________________________________________________。
(2)有白色沉淀生成,说明______________________________________________,
红色变浅说明________________________________________________________。
(3)当Ba2+恰好完全沉 淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________
淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________ ___________________________________________________。
___________________________________________________。
(4)若向(3)得到的 溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
| A.KI溶液 | B.淀粉溶液 | C.NaOH溶液 | D.稀H2SO4E.氯水 |
发现溶液颜色按如下顺序变化:①无色―→②棕黄色―→③蓝色―→④无色―→⑤蓝 色。依据溶液颜色的变化,回答下列问题:
色。依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号)_______________________________________。
(2)①―→②反应的化学方程式为_________________________________________。
(3)溶液由棕黄色变为蓝色的原因是_______________________________________。
(4)③―→④反应的化学方程式为__________________________________________。
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。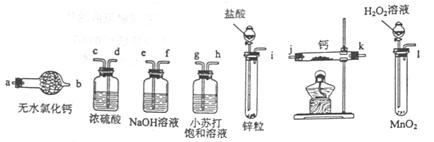
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式___________________;
②该同学的判断不正确,原因是_________________;
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象___________;
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。