下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是
| A.Na+、K+、Cl-、CO32- | B.Cu2+、Na+、SO42-、CO32- |
| C.Ba2+、K+、Cl-、SO42- | D.K+、Na+、HCO3-、NO3- |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
下列关于实验现象的描述不正确的是
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
B.用锌片做阳极,铁片做阴 极,电解氯化锌溶液,铁片表面出现一层锌 极,电解氯化锌溶液,铁片表面出现一层锌 |
C.把铜片插 入三氯化铁溶液中,在铜片表面出现 入三氯化铁溶液中,在铜片表面出现 一层铁 一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
将氨水缓缓地滴入盐酸中至中性 ,下列有关的说法正确的是:①盐酸过量②氨水过量③恰好完全反应④c (NH4+) = c(Cl-)⑤c (NH4+) < c(Cl-)
,下列有关的说法正确的是:①盐酸过量②氨水过量③恰好完全反应④c (NH4+) = c(Cl-)⑤c (NH4+) < c(Cl-)
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
下列水解的离子方程式正确的是
A.HS-+H2O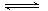 S2-+H3O+ S2-+H3O+ |
B.Fe3++3H2O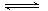 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
C.CO32-+2H2O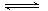 H2CO3+2OH- H2CO3+2OH- |
D.NH4++H2O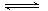 NH3·H2O+H+ NH3·H2O+H+ |
下列叙述的说法不正确的是
| A.金属的电化学腐蚀比化学腐蚀更普遍 | B.用牺牲锌块的方法来保护船身 |
| C.用铝质铆钉铆接铁板,铁板易被腐蚀 | D.在镀件上电镀锌,用锌作阳极 |