(A)【化学—物质结构与性质】
物质中铁含量的测定方法是多种多样的。
I.土壤中铁含量的测定是先将Fe3+还原为Fe2+,然后使Fe3+与邻啡罗啉 结合显橙红色,再用比色法测定。其中涉及反应:4FeCl3 + 2NH2OH·HCl ="==" 4FeCl2 + N2O↑+ 6HCI + H2O
结合显橙红色,再用比色法测定。其中涉及反应:4FeCl3 + 2NH2OH·HCl ="==" 4FeCl2 + N2O↑+ 6HCI + H2O
(1)基态Fe2+的核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子是 ;
羟胺极易溶于水,主要原因是 。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。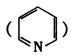
(4)吡啶和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理:3K4Fe(CN)6+4FeCl3 ="==" Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有 ;
a.共价键
b.氢键
c.配位键
d.金属键
e.离子键
(6)若K4 Fe(CN)6和FeCl3的物质的量按某种比例发生反应,可生成普鲁士蓝(I),其晶胞结构如下图所示:据此判断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)= 。
随着上海工农业生产的发展和城市居民生活水平的提高,环境污染日趋严重。每天有大量的工业废水和生活污水排入黄浦江;农村养殖、耕作方式发生了改变,猪饲料由“水花生”等天然饲料转变为人工复合饲料。农作物施肥由人畜粪尿变成以化肥为主,而大量的人畜粪尿也被倒入河流,造成黄浦江水体严重污染,生态平衡严重失调。请根据以上资料分析:
(1)造成黄浦江水污染的主要原因是。
(2)造成黄浦江水域“水花生”大量生长繁殖的元凶是
①;②。
(3)控制黄浦江水体污染的根本措施是。
为了获取大量的生活饮用水,自来水厂需要用适宜、高效的方法和流程将天然水悬浮物、致病细菌等有害成分降低到规定的含量。
(1)要达到上述目的,一般要经过的基本步骤是:①沉降、②、③曝气、④。“曝气”的主要目的是。
(2)在第①步中,下列物质可以使用的是(用符号填空)。
A.明矾 B.膨润土 C.烧碱
(3)在将天然水制成生活饮用水的过程中,水中不需要除去的成分是(至少答出一项)。
(4)在经过上述四个步骤的处理之后,如果水中Ca2+、Mg2+的含量超标,还要将水进行。
(1)水中的重金属污染物主要包括、、、等,它们能在生物体内,不易排出体外,故危害很大。水中的重金属污染物可以通过水中的,浓度逐级加大,而人正处于,通过食物或饮水,将这些重金属摄入体内,引起人体急性或慢性中毒。
(2)写出水中的无机汞(如HgCl2)在微生物作用下转化为甲基氯化汞的化学方程式。蛋白质水解的产物NH3在微生物作用下,进一步氧化为,进而氧化为,其过程用化学方程式表示为,。
在人口居住密度较大的城区和建筑群中,室内空气的污染有时会比室外更严重。目前已发现的室内空气污染物达300多种。
(1)室内装修材料及家具挥发出来的甲醛是室内空气的主要污染物,甲醛易溶于水,常温下有强烈的刺激性气味,当温度超过20 ℃时,挥发速度加快,根据甲醛的这些性质,下列做法错误的是 。
| A.入住前房间内保持一定温度并通风 |
| B.装修尽可能选择在温度较高的季节 |
| C.请环境监测部门检测室内甲醛含量低于国家标准后入住 |
| D.紧闭门窗一段时间后入住 |
(2)请写出除甲醛外的常见的两种室内空气污染物_________________________________。
(3)在入住装修过的新房之前在房间内,放置适量的吊兰、芦荟等植物有利
于净化空气,但晚上在密闭的居室内放置大型绿色植物,可能影响人体健康。
主要原因是其_________________________________________________。
我国农业因遭受酸雨而造成每年高达15亿多元的损失。为有效地控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。回答下列问题:在英国进行的一个研究结果表明:高烟囱可以有效地降低地面SO2的浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
_________________________________________________________________。