由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,(SO42—)=0.8 mol·L-1,则c(K+)为
| A.0.15 mol·L-1 | B.0.2 mol·L-1 | C.0.3 mol·L-1 | D.0.4 mol·L-1 |
下列图示与对应的叙述相符的是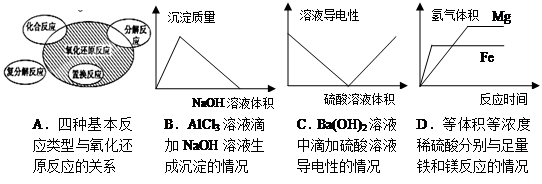
由二氧化硅制高纯硅的流程如下,下列判断中错误的是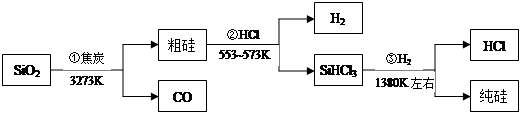
| A.①②③均属于氧化还原反应 | B.H2和HCl均可循环利用 |
| C.SiO2是一种坚硬难熔的固体 | D.SiHCl3摩尔质量为135.5g |
以下物质间的每步转化通过一步反应就能实现的是
| A.NaHCO3→CO2→Na2CO3 | B.Fe→FeCl3→FeCl2 |
| C.Si→H2SiO3→Na2SiO3 | D.Al2O3→Al(OH)3→NaAlO2 |
下列离子方程式书写正确的是
| A.钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓ |
| C.碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| D.NaOH溶液中通入少量SO2:2OH-+SO2 ══ SO32-+H2O |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A. |
将气体X通入品红溶液中 |
红色褪去 |
X一定是SO2 |
| B. |
向无色溶液中加硝酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中定含SO42- |
| C. |
向Na2SiO3溶液中通入适量CO2气体 |
出现白色沉淀 |
H2CO3的酸性比H2SiO3强 |
| D. |
向某溶液中先加氯水再加KSCN溶液 |
溶液呈血红色 |
原溶液中定含Fe2+ |