在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
| A.Na+、Ag+、CO32-、Cl- | B.K+、Ba2+、SO42-、Cl- |
| C.Na+、K+、CO32-、Cl- | D.Na+、K+、Cl-、SO42- |
对于反应A + B = C,下列条件的改变一定使化学反应速率加快的是( )
| A.升高体系的温度 | B.增加体系的压强 |
| C.增大C的物质的量浓度 | D.增加A的物质的量 |
将NaCl溶液在一块光亮的清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区是液滴之下氧气会含量比边缘少。下列说法正确的是 ( )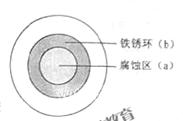
| A.液滴中的Cl-由a 区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-==4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,在b区形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaC1溶液,则负极发生的电极反应为:Cu-2e-="=" Cu2+ |
在某容积一定的密闭容器中,可逆反应:A(g)+B(g) 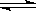 XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是()
XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是()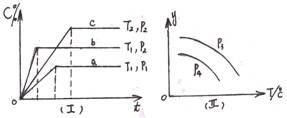

短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是()
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |