下列解释实验事实的方程式正确的是
| A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3+ + 3OH-= Al(OH)3 ↓ |
B.90℃时测得纯水中c(H+)·c(OH-) =3.8×10-13:H2O(l) H+(aq) + OH-(aq) △H<0 H+(aq) + OH-(aq) △H<0 |
| C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2+ + SO42-+ 4H+ |
D.碳酸钠溶液滴入酚酞变红:CO32-+ 2H2O  H2CO3 + 2OH- H2CO3 + 2OH- |
已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数( )
| A.等于15% | B.大于15% | C.小于15% | D.无法估算 |
V mL Al2(SO4)3溶液中有a g Al3+,取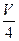 mL溶液稀释到4 V mL,则稀释后溶液中
mL溶液稀释到4 V mL,则稀释后溶液中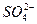 的物质的量浓度是()
的物质的量浓度是()
A.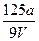 mol·L-1 mol·L-1 |
B.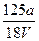 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D.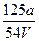 mol·L-1 mol·L-1 |
300 mL某浓度的NaOH溶液中含有60 g溶质。现欲配成1 mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为(设溶液密度不变)()
| A.1∶4 | B.1∶5 | C.2∶1 | D.2∶3 |
相对分子质量为M的某物质在室温下的溶解度为s g/100 g水,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液的物质的量浓度为( )
A. mol·L-1 mol·L-1 |
B.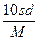 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D. mol·L-1 mol·L-1 |
某金属氯化物的溶液20 mL,物质的量浓度为0.05 mol·L-1,恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则该氯化物的化学式为( )
| A.RCl2 | B.RCl | C.RCl3 | D.RCl4 |