已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是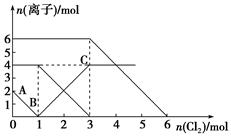
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是
| A.Ba(OH)2 | B.H2S | C.NaOH | D.AgNO3 |
下列关于定量测定的说法,错误的是
| A.发现操作失误,应该重做实验 | B.测定结果有偏差,也要记录在实验报告上 |
| C.误差分析后,可更改数据 | D.实验报告不能预先完全做好 |
金属在生产和日常生活中有重要的应用。下列说法不正确的是
| A.明矾水解形成胶体能吸附水中悬浮物,可用于水的净化。 |
| B.现代建筑的门框架,常用古铜色的硬铝制造,硬铝含有的元素是Al、Cu、Mg等。 |
| C.金属在自然界中一般以化合态存在,越活泼的金属越难冶炼。 |
| D.日常生活中应用的金属材料一般为合金,合金的熔点一般比组分金属高。 |
下列性质中,不属于金属共同性质的是
A导电、导热性B、金属光泽C、熔点较高 D、延展性
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为()
| A.(b-a) /V mol·L-1 | B.(2b-a)/V mol·L-1 |
| C.2(b-a)/V mol·L-1 | D.4(2b-a)/V mol·L-1 |