下列离子反应方程式错误的是
| A.向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+ 2H+=H2SiO3(胶体) |
| B.向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| C.将Cu片加入稀硝酸中:3Cu + 8H++2NO3-=3Cu2+ +2NO↑+4H2O |
| D.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4+ + Al3+ + 2SO42- + 2Ba2+ + 5OH-=2BaSO4↓+ NH3·H2O + AlO2-+ 2H2O |
将a g Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
| A.0.1 mol·L-1 | B.0.2mol·L-1 | C.0.4 mol.L-1 | D.0.8mol·L-1 |
如下图是NaCl晶体的一个晶胞结构模型。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-位置用O2-代替,则关于KO2晶体结构的描述正确的是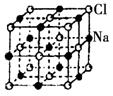
| A.与K+距离相等且最近的O2-共有8个 |
| B.与K+距离相等且最近的O2-构成的多面体是8面体 |
| C.与K+距离相等且最近的K+有8个 |
| D.一个KO2晶胞中摊得的K+和O2-粒子数均为6个 |
某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、OH-、Zn2+、SO |
B.Na+、Ba2+、NO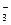 、OH-、SO 、OH-、SO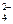 |
C.MnO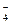 、K+、Cl-、H+、SO 、K+、Cl-、H+、SO |
D.K+、NO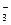 、SO 、SO 、OH-、Na+ 、OH-、Na+ |
下更离子方程式书写正确的是
| A.等体积的氯气和二氧化硫同时通入一定量水中:Cl2+SO2+2H2O====4H++2Cl-+SO42- |
| B.过量二氧化碳通入铝酸钠溶液中:CO2+2H2O+AlO-2====Al(OH)3↓+CO32- |
C.在溶液中亚硫酸氢铵与等物质的量的氢氧化钠混合:NH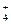 +HSO +HSO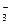 +2OH-====SO +2OH-====SO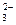 +NH3↑+2H2O +NH3↑+2H2O |
D.碳酸氨镁溶液中加入过量石灰水:Mg2++2HCO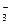 +Ca2+2OH-====CaCO3↓+2H2O+MgCO3↓ +Ca2+2OH-====CaCO3↓+2H2O+MgCO3↓ |
在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3KJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A.SO2(g)+1/202(g) SO3(g);△H=-98.3KJ·mol-1 SO3(g);△H=-98.3KJ·mol-1 |
B.2SO2(g)+O2(g) SO3(l);△H=-196.6KJ·mol-1 SO3(l);△H=-196.6KJ·mol-1 |
C.SO2(g)+1/2O2(g) SO3(g);△H=-78.64KJ·mol-1 SO3(g);△H=-78.64KJ·mol-1 |
D.2SO2(g)+O2(g) SO3(g);△H=+196.6KJ·mol-1 SO3(g);△H=+196.6KJ·mol-1 |