(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
| 物质 |
开始沉淀的pH值 |
完全沉淀的pH值 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.4 |
4.4 |
| Cr (OH)3 |
4.6 |
5.9 |
| Fe(OH)2 |
7.5 |
9.7 |
| Bi(OH)3 |
0.7 |
4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空: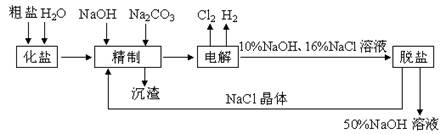
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
(8分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
【提出猜想】
猜想一:所得气体中可能是SO2。
猜想二:所得气体中可能是。
猜想三:所得气体中可能是的混合气体。
【实验探究】
(1)将所得气体通入如下装置
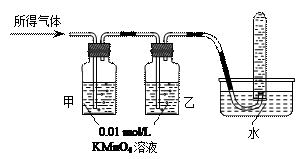 |
证明猜想三正确的实验现象;
(2)点燃试管中的气体前,必须要进行的操作是。
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为
其中浓H2SO4的作用是和
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置: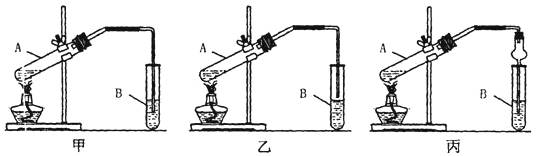
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是
[实验步骤]
①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论](1)步骤①装好实验装置,加入样品前还应检查
(2)试管B中饱和Na2CO3溶液的作用是
(3)从试管B中分离出乙酸乙酯的实验操作是
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有、;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有、(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| A |
B |
C |
D |
E |
F |
|
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
(1)A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。则元素符号为A,
B,C,D;D的最高价氧化物对应水化物的化学式为;AB2 的电子式为。
(2)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验,请回答有关问题。
(ⅰ)步骤①灼烧海带时,除需要三脚架、坩埚、泥三角外,还需要用到下列仪器中的。
A.烧杯 B. 酒精灯 C.表面皿 D. 干燥器
(ⅱ)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分
离出单质碘和回收苯,该步骤的实验操作名称是。
(ⅲ)步骤④的反应中碘离子被(填“氧化”或“还原”)。
(ⅳ)检验单质碘的方法是。