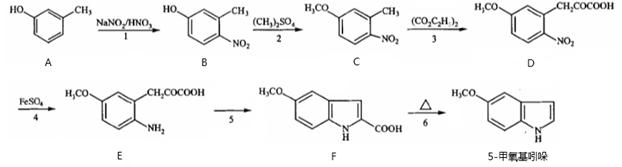
(15分)5-甲氧基吲哚是合成褪黑素的原料,可通过以下方法合成:
请回答下列问题:
(1)B中的含氧官能团为 和 (填名称)。
(2)反应3中加入的试剂的结构简式为(CO2C2H5)2,反应生成D和 (填结构简式)。
(3)在上述六步反应中,属于取代反应的是 (填序号)。
(4)C的一种同分异构体满足下列条件:
Ⅰ.能与FeCl3溶液发生显色反应。
Ⅱ.水解产物之一为天然氨基酸,另一种水解产物只有2种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 和(CO2C2H5)2为原料制备
和(CO2C2H5)2为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

某芳香烃A有如下转化关系:
按要求填空:
(1)写出D中所含官能团的名称,指出⑤的反应类型。
(2)反应②的反应条件是。
(3)写出A和F结构简式:A;F。
(4)写出反应③对应的化学方程式:。
(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式:。
(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。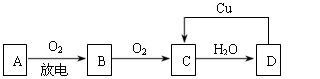
请回答下列问题:
(1)写出A和C的名称或化学式: A ,C ;
(2)在上图D→C的过程中,D表现出强(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是。
某科研小组合成纳米人的其中一部分,具体反应式如下所示(各反应均在一定条件下进行,方程式中条件省略)。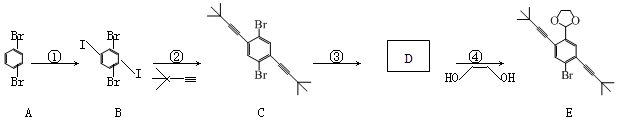
请回答下列问题:
(1)A→B的反应类型是;
(2)已知物质D可以发生银镜反应,D的相对分子质量为345,分子中有一个氧原子、一个溴原子,含碳66.1%,其余为氢, 计算物质D的分子式为;
(3)写出D→E的化学反应方程式:;
(4)下列关于物质E的说法不正确的是;(双选)
a.能与银氨溶液反应
b.1 mol E最多能和7 mol氢气反应
c.不能与硝酸银溶液反应生成黄色沉淀
d.核磁共振氢谱中有3个吸收峰
(5)物质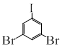 和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式:。
和物质HC≡C-CH3也可以发生类似反应②的反应,写出该反应的化学方程式:。
现以有机物M:CH2=C(CH3)2为原料按下列方式合成环状化合物D。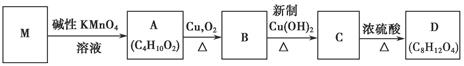
已知:具有碳碳双键结构的有机物可被碱性高锰酸钾溶液氧化成二元醇,如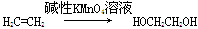 。
。
请回答下列问题:
(1)用系统命名法给物质M命名为;A物质的结构简式为;
(2)B物质的含氧官能团的名称为;
1mol C物质完全燃烧消耗氧气的物质的量为;
(3)已知B物质有多种同分异构体,写出其中能发生水解,且存在异丙基结构的同分异构体的结构简式:;
(4)写出C→D的化学反应方程式:。
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如下图所示的反应。甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体。请回答下列问题。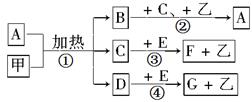
(1)G的化学式为:____________________________________
(2)①反应的化学方程式为:____________,②反应的离子方程式为_______________。
(3)③反应的离子方程式为:______________________________,每生成 1 mol 乙气体,反应中转移____________mol 电子。