碳酸锂,可用于制陶瓷、药物、催化剂等,常用的锂离子电池原料。以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
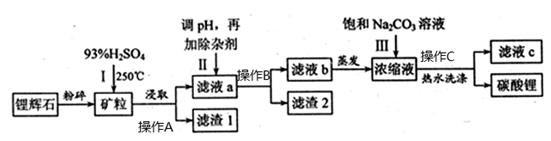
已知:①2LiAlSi2O6+H2SO4(浓) 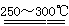 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如右表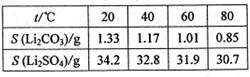
请回答下列问题:
(1)操作A、操作B、操作C是 ,锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+ 、Ca2+、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的pH到6.0~6.5,此时沉淀的杂质离子有 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生反应的离子方程式有 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 ,检验是否洗涤干净的方法是 。
(5)从滤液c中可回收的主要物质是 。
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.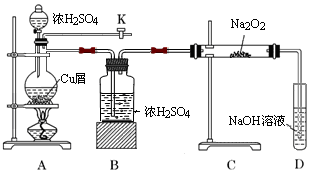
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是。
(2)B装置的作用是。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
① 停止加热后,再通入N2至整套装置冷却,其目的是。
② 取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有。
③D装置中发生反应的离子方程式是。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
| A.Cu | B.CuO | C.CuS | D.Cu2S |
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为
a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。
连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:。装置E中观察到的主要实验现象有。
(3)装置C的作用是。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为;
(2)探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。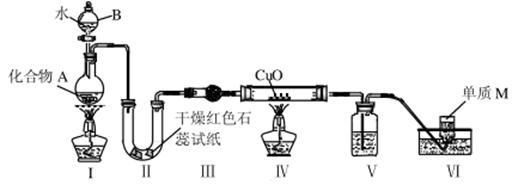
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为____________;Ⅳ中发生反应的化学方程式为____________________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ 中现象为_____,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为__________。
(14分)某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出。
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③很多合金是金属互化物,有确定的化学组成。
④固体L与某种宝石的主要成分相同。
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式。
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 |
实 验 步 骤 |
实 验 现 象 |
结论 |
| ① |
取少量该焰火原料加入冷水 |
无明显现象 |
不含有Li、Na等活泼金属 |
| ② |
取少量该焰火原料加入稀盐酸 |
完全溶解,有大量气体 |
_____________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论_________(选填“正确”或“错误”)。判断理由为。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。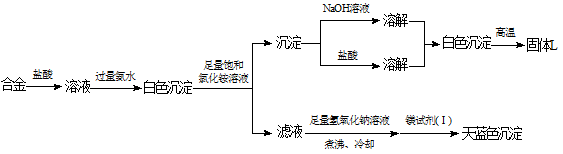
由丙的实验记录可知,该焰火原料是由__________(填元素名称)两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是_____________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
a.m、n b.m、yc.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________。