【选做】【化学—化学与技术】
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如图: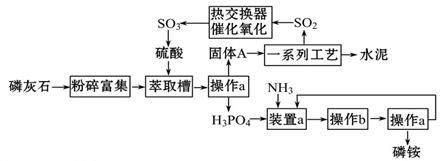
回答下列问题:
(1)操作a的名称是___________,实验室中进行此操作的非玻璃仪器或用品有________________;在实验室中操作b的名称是______________________。
(2)装置a中生成两种酸式盐,它们的化学式分别是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是____________________(结晶水部分不写)。
(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀硫酸 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |
下表是元素周期表的一部分,请回答有关问题:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 2 |
① |
② |
③ |
|||||||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的
单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)④元素与⑦元素形成化合物的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
除去下列物质中的杂质(括号内),填入所用试剂和分离方法或化学方程式。
(1)乙烯(SO2):试剂,分离方法
(2)苯(溴):试剂,分离方法
(3)乙烷(乙烯)试剂,化学方程式
下面列出了几组物质,请将物质的合适组号填写在空格上。同位素,同系物,同分异构体,同素异形体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;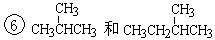 ;
;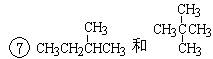
(14分)向体积为 2L 的固定密闭容器中通入3molX 气体 , 在一定温度下发生如下反应:2X (g) Y (g) +3Z (g)
Y (g) +3Z (g)
(1). 经 5min 后反应达到平衡 , 此时测得容器内的压强为起始时的 1.2 倍 , 则用 Y 表示的速率为mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行 , 在同一段时间内测得容器内的反应速率分别为 : 甲、 v (X) ="3." 5 mol/L·min; 乙、 v (Y) ="2" mol/L·min; 丙、 v (Z) ="4." 5 mol/L·min; 丁、 v (X) ="0." 075 mol/L·s。若其它条件相同 , 温度不同 , 则温度由高到低的顺序是 ( 填序号〉
(3) 若向达到 (1) 的平衡体系中充入惰性气体, 则平衡向( 填"左"或"右"或"不)移动;若向达到 (1) 的平衡体系中移走部分混合气体 , 则平衡向( 填 " 左 " 或 " 右 " 或 " 不 ") 移动。
(4)若在相同条件下向达到 (1) 所述的平衡体系中再充入 0.5molX 气体 , 则平衡后 X 的转化率与(1) 的平衡中的 X 的转化率相比较
| A.无法确定 | B.前者一定大于后者 | C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度和压强不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 则 : a 、b 、c应该满足的关系为
(6)若保持温度和体积不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 且起始时维持化学反应向逆反应方向进行 , 则c 的取值范围应该为
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)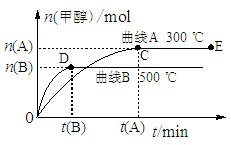
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______________________________ (用化学方程式表示)。