选考【化学——选修3物质结构与性质】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3
与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
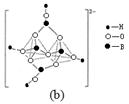
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。

(5)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是▲(填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是▲。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为▲。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有▲。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为▲;该晶体的化学式为▲。
目前,聚氯乙烯塑料(PVC)占塑料消费量的30%以上,BICM法用乙烯、氯气等为原料合成PVC,其工艺流程如下。
⑴一定条件下,HCl与O2反应制取Cl2的方法称为地康法,其热化学反应方程式为:
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)ΔH=-114.4kJ·mol-1。
2Cl2(g)+2H2O(g)ΔH=-114.4kJ·mol-1。
升高温度,该反应的化学平衡常数K会▲。
A.增大 B.减小 C.不变 D.无法确定
⑵一定温度下某体积可变的容器中充入4LHCl气体和6L空气(氧气占20%),充分反应后气体体积为9.2L。该反应中HCl气体的转化率为▲。
⑶假设BICM法中各步反应的转化率均为100%,计算生产1000吨PVC需要购得的氯气质量。
喹硫平可用于精神疾病的治疗,其结构为:
( )2·
)2· ,它的合成路线如下:
,它的合成路线如下:
已知:(Ⅰ)反应①为取代反应;(Ⅱ)A的系统命名为1,4-二溴―2―丁烯。
请回答下列问题:
⑴写出分子式为C13H9NO4S的物质的结构简式▲。
⑵物质 中除硫醚键(-S-)外,还含有的官能团名称为▲。
中除硫醚键(-S-)外,还含有的官能团名称为▲。
⑶反应③的类型是▲反应,反应⑤的目的是▲。
⑷写出反应④的化学方程式▲。
⑸物质B的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有▲种。
⑹已知:-SH的性质与-OH相似。
物质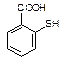 一定条件下形成聚合物的结构简式为▲。
一定条件下形成聚合物的结构简式为▲。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是▲。
⑵选择性催化还原法的脱硝原理为:
6NOx+4x NH3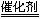 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为▲L。
②已知:2H2(g)+O2(g) =2H2O (g)ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g)ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g)ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=▲。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
图1图2
①写出该脱硝原理总反应的化学方程式:▲。
②为达到最佳脱硝效果,应采取的条件是▲。
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一
 |
种红棕色固体氧化物。
请回答下列问题:
⑴C的电子式为▲。
⑵检验溶液L中金属阳离子的方法是▲。
⑶反应③的离子方程式为▲。
⑷F与G的浓溶液反应的化学方程式为▲。
⑸气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为▲。