研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:①Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH1=+489.0 kJ/mol,
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)①分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。则该电池的负极反应式: 。
②用上述燃料电池用惰性电极电解足量MgCl2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
(3)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:

①该反应的平衡常数表达式K= 。
②一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8分钟内,CO的平均反应速率v(CO)= mol/(L·min)。
③下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加入一些铁粉 |
④CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图:
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图:

(i)曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
(ii)一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 |
Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是
___________________________________________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
现有铵盐样品A,是(NH4)2SO4、NH4HSO4的混合物。为确定A中各成分的含量,某研究性学习小组的同学取了数份相同质量的样品A溶于水,然后分别加入不同体积的1 mol/L的NaOH溶液,水浴加热至气体全部逸出(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图所示。分析该图象并回答下列问题: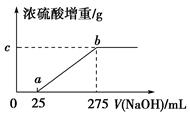
(1)写出ab段涉及的离子方程式:_____________________________。
(2)c点对应的数值是________;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为________。
对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别。
| 牙膏 |
两面针儿童牙膏 |
珍珠王防臭牙膏 |
中华透明牙膏 |
| 摩擦剂 |
氢氧化铝 |
碳酸钙 |
二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
(2)根据你的推测,牙膏摩擦剂的溶解性是________________________
(填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为: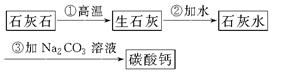
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①________________________________________________;
②________________________________________________;
③________________________________________________。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石―→
你设计的方案的优点为:________________________________。
(5)检验牙膏中是否含有碳酸钙的实验方法是:__________________。
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.l0g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为______。
(2)另取4.05g白玉粉末加入l mol/L的盐酸l00mL中充分溶解,最终得不溶氧化物2. 40g.过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(标准状况下).则
①p=_________;
②白玉的化学式(用氧化物的形式)表示为________。
2004年诺贝尔化学奖授予阿龙.切哈诺沃等三位科学家,以表彰他们发现了泛素调节的蛋白质降解。化合物A是天然蛋白质水解的最终产物,其相对分子质量为165,其中O元素的质量分数小于20%,N元素的质量分数小于l0%。
(1)A的分子式为_______。
(2)光谱测定显示,化合物A分子结构中不存在甲基(-CH3),则化合物A的结构简式为_______ 。
(3)写出A发生缩聚反应的化学方程式_______。