常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是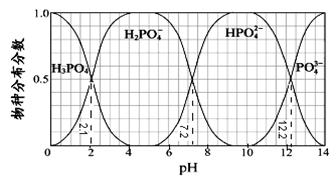
| A.H3PO4的Ka3=10–12.2,HPO42–的水解平衡常数为10–6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42–)>c(PO43-)>c(OH-)>c(H+) |
下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
⑤ 浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
| A.①③④ | B.①② | C.① | D.①②⑤⑥ |
下列叙述不正确的是
| A.NH3易液化,氨常用作制冷剂 |
| B.铝盐和铁盐可以用于净水 |
| C.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 |
| D.淘金者利用密度的不同,用淘洗的方法将金子从沙里分出来 |
下列实验现象与氧化还原反应有关的是
| A.蘸有浓盐酸和浓氨水的玻璃棒互相靠近,产生大量白烟 |
| B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
| C.将装有NO2 的试管倒立于水中,管内气体由红棕色逐渐转变为无色 |
| D.硫酸铁溶液中滴加硫氰化钾溶液变红 |
下列关于硝酸的叙述中正确的是
| A.稀硝酸是弱酸,浓硝酸是强酸 |
| B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮 |
| C.浓硝酸能使紫色石蕊溶液先变红后褪色 |
| D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化 |
某溶液中含有较大浓度的H+、Fe2+、SO42-时,下列物质可以在其中大量存在的是
| A.CuCl2 | B.Cl2 | C.NaNO3 | D.NH3 |