对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强.常温下,20%的稀硫酸的pH (填“大于”“小于”或“等于”)10%的稀硫酸的pH。如果要使10%的稀硫酸的pH升高,可采取如下方法:
(1)发生化学反应的方法:可以加入的物质是(要求物质的类别不同) 、 。
(2)通常类别相同的物质具有相似的化学物质,稀盐酸、稀硫酸有许多相似的化学性质,是因为_____。
(3)【查阅资料】资料一:已知复分解反应CaCO3 +2HC1= CO2↑+ H2O + CaCl2可自发进行。在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是(填字母)_______
图示是某化学反应的微观示意图.
(1)根据图示,请从微观角度描述你获得的关于化学变化的一个信息.
(2)写出该反应的化学方程式.
请结合图示,回答下列问题:
(1)请你在图中用画图或文字表述的方式简单形象地表达“地球”的感受.(2)这种现象可能对人类生存环境造成的不良影响是
(3)你的建议是.
在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
(1)樟脑是一种白色晶体,可以散发出特殊气味,使衣物免受虫蛀。樟脑的化学式为C10H16O,樟脑的组成元素有 种,其中氢元素和氧元素的质量比为 。
(2)可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。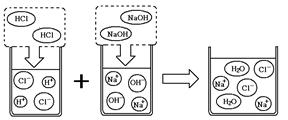
部分碱和盐的溶解性表(20 ℃)
|
Na+ |
K+ |
Ba2+ |
||||
| OH– |
溶 |
溶 |
溶 |
||||
| SO42- |
溶 |
溶 |
不 |
||||
| CO32- |
溶 |
溶 |
不 |
①如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是 (填离子符号)。
②根据上述微观示意图写出化学方程式 ,判断反应前后溶液中数目发生变化的粒子是
(填粒子符号)。
③根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有 个。
(7分)利用金属及金属活动性顺序的有关知识解决下列问题。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的(选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式;若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL)mL。
(3)某校实验室废水中含有Zn(NO3) 2、AgNO3、Cu(NO3) 2三种物质。该校化学兴趣小组的同学为了从中分离、回收金属Ag和Cu,设计了如下实验方案(实验中未引进其它金属离子):
回答问题:
①固体X是。
②写出实验过程中所发生反应的化学方程式。
下图是有关氧气的知识网络图(部分反应条件已略去)。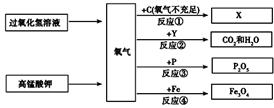
根据上图回答下列问题:
(1)生成氧气的两个反应都属于________反应(填基本反应类型),从节能、环保的角度
考虑,实验室制取氧气最好选用_________________作反应物。
(2)X的化学式为;若反应①在氧气充足的条件下进行,生成X的化学式
为。
(3)若反应②的化学方程式为Y+5O2点燃3CO2+4H2O,Y的化学式为。
(4)写出反应③的化学方程式______________________________。
(5)在做反应④实验时,要预先在盛放氧气的集气瓶中放______________________。