请根据下列描述填空。
(1)还原铁粉常用做食品除湿剂(干燥剂),又称“双吸剂”。它能够吸收空气中的 和 。误食该物质,在胃中可能发生的化学反应方程式是 ,该反应的基本反应类型是 。
(2)空气中的负离子享有“空气维生素”的美誉。空气中的负离子主要有羟离子(H3O2—)、氢氧根离子 (表达该离子符号)、负氧离子(O2—)等。写出负氧离子与钾离子结合的物质的化学式 。
(3)当汽车受撞击后,汽车安全气囊中的NH4NO3固体瞬间分解成N2O和一种常温下的无色液体,反应方程式是 ,汽车尾气中的CO、NO2是大气污染物,可通过三效催化转化器将其转化为无污染的两种气体,则反应方程式是 。
(4)某试剂瓶上的标签已破损,残余部分如图。
①请猜测瓶中的试剂可能是 。
②取瓶中的试剂少许溶于水,发现放出大量的热,所得溶液能使PH试纸变 色。
③用该稀溶液除铁锈(Fe2O3)的反应方程式是 。
化学与生活密切相关。
(1)下列日常生活中的做法,符合“低碳生活”理念的是________。
A.节约使用纸张 B.分类回收处理垃圾
C.减少使用塑料袋 D.减少使用一次性纸杯
(2)上海世博会使用的LED灯,为其提供电的装置接受阳光照射后,便可将转化为电能。
(3)为减少煤燃烧产生的二氧化硫对大气的污染,可向煤中加入适量的石灰石,发生的化学反应为:2CaCO3+O2+2SO2=2CaSO4+2CO2,该反应所涉及的物质中,属于氧化物的是____________。
(4)目前使用的能源多为化石燃料,如天然气、石油和。由于化石燃料属于不可再生资源、燃烧的产物有污染,所以人们正在利用和开发新的能源,如氢能、和太阳能等。氢能是理想的清洁能源,科学家正研究使用太阳能发电的方法将水分解得到氢气,推广使用太阳能是利用了太阳能(填字母)的特点。
A.取之不尽 B.清洁能源 C.不可再生能源 D.可转变成电能、热能
(1)现有乙醇、水银、一氧化碳、二氧化硫四种物质,其中(用化学式填写):
①能与血红蛋白结合引起中毒的是;②常温下为液体的金属是;
③属于可再生能源的是;④造成酸雨的主要气体是。
(2)填表:物质的性质决定用途,填写下列物质的用途所对应的性质。
| 序号 |
物质 |
用途 |
性质 |
| ① |
铝 |
制铝箔及电缆线 |
|
| ② |
二氧化碳 |
灭火 |
科学探究是科学研究与学习的一种重要方式。
请完成下列有关探究技能的问题。
(1)找证据:收集、分析各种证据是认识物质的基本方法。如汗液有咸味,因此有同学认
为汗液中有氯化钠。为了验证猜想,他收集了一定量的汗液,然后向其中滴加一种化学试剂,
看到有白色沉淀生成,这种化学试剂是。
(2)推理:食盐和工业用盐(主要成分为亚硝酸钠,化学式NaNO2)都有咸味,但亚硝酸
钠对人体是有剧毒的。比较食盐和亚硝酸钠的化学式,可推断亚硝酸钠组成成分中的
是有剧毒的。(用化学符号表示)
(3)处理数据:在测定硫酸铜晶体结晶水质量分数的实验中,得到的数据如表:(已知坩埚质量为8.7克)则该实验测得硫酸铜晶体中结晶水的质量分数为。
| 次 数 |
1 |
2 |
3 |
4 |
5 |
| 坩埚和硫酸铜晶体总质量(g) |
10.7 |
10.1 |
9.8 |
9.8 |
9.8 |
已知Fe2O3在氢气流中加热时,在不同的温度条件下
可生成Fe3O4、FeO或Fe,上述反应利用了氢气的性。为了探究某次实验中氢气与氧
化铁反应的产物,某科学兴趣小组将反应生成的固体称量后放入硫酸铜溶液中(已知铁的氧
化物不与硫酸铜反应,且不溶于水)。一段时间后过滤,将得到的固体干燥并再次称量,若
发现固体质量(填“增加”、“减少”或“不变”),则可认为产物中有Fe。
某校“我与化学”活动小组通过查舞资料了解到,我国超市每年消耗约40万吨塑料袋。假定这些使用后的废塑料袋都通过焚烧处理。将排放大量CO2。该活动小组用下图所示装置,测量一定质量塑料袋燃烧后产生的CO2的质量。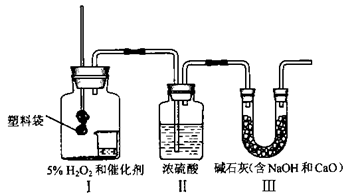
(1)为了保证测量的准确性,连接好实验装置后应检查________________________,再加入药品进行实验。
(2)装置Ⅰ的小烧杯中加入足量H2O2和催化剂.可持续产生O2供塑料袋充分燃烧,产
生O2的化学方程式是__________________________。
(3)塑料袋燃尽,装置Ⅰ逐渐冷却时,装置Ⅱ中液体也不易倒吸进入装置Ⅰ中.原因是___________________
(4)根据实验目的,需要称量的是_________。
A.实验前塑料袋的质量
B.实验前和实验后装置Ⅱ的质量
C.实验前和实验后装置Ⅲ的质量