某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
| 实验 |
药品 |
制取气体 |
量气管中液体 |
| Ⅰ |
铜片,浓HNO3(过量) |
NO2 |
CCl4 |
| Ⅱ |
|
NH3 |
煤油 |
| Ⅲ |
MnO2,HCl(浓) |
Cl2 |
|
| Ⅳ |
硅铁合金,NaOH溶液 |
H2 |
H2O |
请回答下列问题:
(1)实验前,某同学检查装置气密性的操作方法是:将活塞K关闭,再将量气管向上提高,其判断装置漏气或不漏气的现象分别是_____
(2)另一同学欲通过实验Ⅰ收集并测量NO2气体的体积来探究铜片的纯度,所测得的结果比真实值偏小(不考虑操作误差),你认为可能的原因是____。
(3)若进行实验II制NH3,则烧瓶和分液漏斗中应分别盛装适量的____。
(4)若进行实验III,该装置缺少的玻璃仪器是____;该反应的离子方程式是_________ 量气管中最好装的液体是_____(选填字母代号)。
a.NaOH溶液 b.水 c.饱和NaCl溶液 d.苯乙烯
(5)实验IV时,应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②_________,③读数时,视线与凹液面最低处水平相切。经多次重复实验,获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
某硅铁合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0 mL |
346.3mL |
| ② |
1.0g |
10.0mL |
336.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出硅铁合金中硅的质量分数为____。
实验室可利用乙醇、铜或铜的化合物制备乙醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是;
(2)两套装置中的A、B处都需加热,
A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(3)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,
B中反应的化学方程式为。
(4)若按乙装置进行实验,则B管中应装,
B中反应的化学方程式为。
(5)实验结束后,将C试管中的溶液滴入新制的氢氧化铜溶液中并加热,可观察到的
现象,写出该过程的化学方程式。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2d. NaOH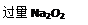
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是(填代表备选试剂的字母);此时A中主要的玻璃仪器有(填名称)。
(2)A中产生的物质被B中 Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:。
Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:。
(3)对于C中发生的可逆反应,下列说法正确的。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
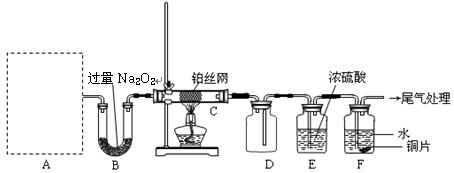
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。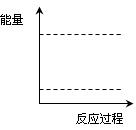
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是mol,甲在标准状况下体积为L(忽略气体溶解)。
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) ▲。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
(1)指出图一装置中的错误之处 ▲, ▲
(2)丙装置的作用 ▲。丙装置中发生反应的离子方程式 ▲。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: ▲。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
▲。
| A.NaBiO3 | B.FeCl3 | C.PbO2 | D.Na2O2 |
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
▲。为什么? ▲。
实验室配制480 mL 0.1mol·L-1 NaOH溶液,回答下列问题
(1)应用托盘天平称取氢氧化钠固体▲g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、▲。
(3)若实验遇下列情况,则所配溶液的物质的量浓度是 A、偏高 B、偏低 C、不变(用符号回答)
①定容时俯视刻度线▲;
②放在滤纸上称量NaOH固体 ▲。
(4)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去(标签如图)。
某化学课外小组用如图装置制取溴苯。先向 分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。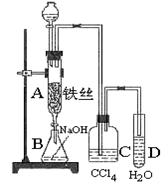
(1)写出A中生成溴苯的化学反应方程式:。
(2)观察到A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是:
。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是。