【化学-选修2:化学与技术】镁合金废料回收最常用的是熔炼法,其主要工艺流程为:
废料预处理→熔化→除铁→除气和除渣→铸造。
(1)废料预处理包括粉碎、除油污和油漆。
①粉碎方法有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是 ,理由是 。
②把油污和油漆一次性除去最适宜的方法是
A.用热碱洗涤,过滤
B.用有机溶剂溶解,过滤
C.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若液态镁与空气接触,不但会发生反应产生杂质,而且降低了镁的回收率。写出与空气的两个主要反应方程式 、 。
(3)向熔融镁中加入固体硼砂(B2O3)除铁,生成FeB2沉渣,写出有关的化学反应方程式 。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4C3沉渣:
C2Cl6→2C+3Cl2 (1)
3C+4Al→Al4C3 (2)
①除气除渣炉排出的污染性气体有 。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6 g。
根据右图装置回答: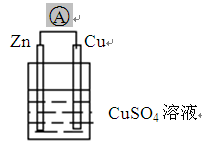
(1)原电池的负极材料是
(2)Cu片上发生反应。(填“氧化”或“还原”)
(3)电流方向由流向(填“Zn”或“Cu”)
(4)写出电极反应式
负极:
正极:
总反应:
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。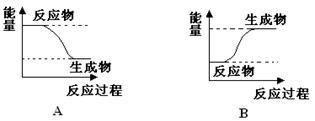
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B” )表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图__________(填“A”或“B” )表示。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
|||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)写出下列元素符号:
B,C,E,
(2)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是。
(3)表中元素,化学性质最不活泼的是,画出其原子结构示意图
只有负价而无正价的是,可用于制半导体材料的元素是_______。
(4)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(5)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(6)在B、C、D、J、 E、F、G、H中,原子半径最大的是.
在 H、
H、 H、
H、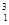 H、
H、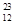 Mg、
Mg、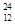 Mg和
Mg和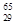 Cu中共有______种元素_______种原子,中子数最多的是________。微粒2311Na+ 中的质子数是___,中子数是_____,核外电子数是____。
Cu中共有______种元素_______种原子,中子数最多的是________。微粒2311Na+ 中的质子数是___,中子数是_____,核外电子数是____。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。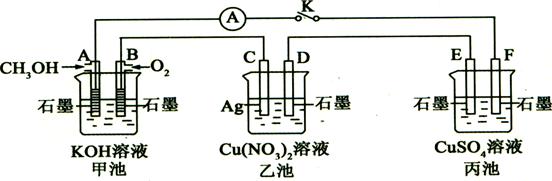
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),
A电极的电极反应式为。
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为。
(3)当乙池中C极质量减轻5.4g时,甲池中B电极理论上消耗O2的体积为ml(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是(填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(0H)2CO3 |