甲、乙、丙、丁4种短周期元素,在周期表中的位置关系如图所示。乙的原子序数大于丙,丁的原子序数与乙、丙原子序数之和相等。4种元素原子的最外层电子数之和为24。下列判断正确的是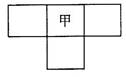
| A.元素甲的简单气态氢化物稳定性比乙的强 |
| B.元素乙在周期表中的位置为第2周期、VIA族 |
| C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
| D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
随着社会的进步,环境问题越来越引起人类的重视,下列有关环境问题描述不正确的是()
| A.水体的富营养化主要是向水体中排放大量含N、P等物质造成的 |
| B.低碳生活是指少用煤炭的生活 |
| C.含氟氯等化合物的大量排放造成了臭氧层空洞 |
| D.光化学烟雾的始作俑者包括NO、NO2等多种气体 |
将a mol FeCl3和b mol FeS混合物加入到某浓度的氢硫酸中,充分反应后,氢硫酸的浓度没有改变(不考虑溶液体积的变化),则a、b的关系是()
| A.a>2b | B.a="b" | C.a≤ 2b | D.a ≥b |
有a、b、c、d四种元素,a、b为同周期元素,c、d为同主族元素。已知a的阳离子和d的阴离子具有相同的电子层结构。b的阴离子和c的阴离子电子层结构相同。且c离子的电荷数大于b离子。则下列说法正确的是( )
①原子序数:d <b< c< a②原子序数:d< a <c <b
③原子序数:d< a< b< c④离子半径:b >c> d> a
⑤离子半径:b> c >a> d⑥离子半径:c> b >d> a
| A.③④ | B.②⑥ | C.①⑤ | D.②④ |
a、b、c、d均为短周期元素,它们在元素周期表中的位置关系如图所示。若b原子的最外层电子数是次外层电子数的3倍。下列说法正确的是()
| A.常见简单离子的半径:c >b> a |
| B.气态氢化物的稳定性:a >c > b |
| C.最高价氧化物对应水化物的酸性:a <d |
| D.a的单质最稳定,不与任何物质发生化学反应 |
原子电子层数相同的三种短周期元素X、Y、Z,已知最高价氧化物对应水化物的酸性HXO4>H2YO4>H3ZO4,则下列判断错误的是()
| A.非金属性:X>Y>Z |
| B.气态氢化物的稳定性:HX>H2Y>ZH3 |
| C.对应的阴离子的还原性:Z3->Y2->X- |
| D.原子半径:X>Y>Z |