工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①2C(焦炭)+O2(空气)=2CO;②Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是( )
| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.CO与Fe2O3的反应有一定限度 |
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是
| A.MFe2O4在与H2的反应中表现了氧化性 |
| B.MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C.MFe2Ox与SO2反应中MFe2Ox被还原 |
| D.若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。
下列有关说法不正确的是
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 物质 编号 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
| ① |
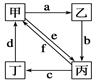 |
Cu[ |
CuO |
CuCl2[ |
Cu(NO3)2[ |
| ②[ |
Na2CO3 |
NaOH |
NaHCO3 |
CO2 |
|
| ③ |
(NH4)2SO3 |
CaSO3 |
SO2 |
NH4HSO3 |
|
| ④ |
Al(OH)3 |
Al2O3 |
NaAlO2 |
AlCl3 |
A.①②③④B.①②③C.①③④D.②④
对下列过程中发生反应的叙述正确的是
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程所涉及的反应均为置换反应 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是
| A.b=2 | B.容器中一定没有残余的CO2和水蒸气 |
| C.a:b≥1 | D.反应中转移的电子数一定为2NA |