(1)已知:C2H6O(g) + 3O2(g) ="=" 2CO2(g) + 3H2O(g) △H1
H2O(g)==H2O(l) △H2 ;
C2H6O(g)==C2H6O(l) △H3
若使1mol C2H6O(l)完全燃烧生成液态水,则放出的热量为 (用符号表示)
(2)对于可逆反应CO(g)+H2O (g)  CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
①恒温恒压时,向容器中充入0.5mol的He,这时反应速率 (填“加快”、“减慢”或 “不变”),原因是 。
②恒温恒容时,加入0.3mol的CO,这时反应速率 (填“加快”、“减慢”或 “不变”),原因是 。
氯化溴(BrCl)的化学性质类似于卤素单质,试回答下列问题:
(1)氯化溴的电子式是,它是由键形成的分子。
(2)氯化溴和水反应生成了一种三原子分子,该分子的电子式为。
工业上可以用石油作原料生产乙醇,反应如下图所示: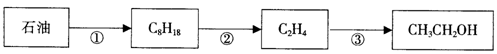
(1)从石油中分离出汽油、柴油、煤油的方法是:
(2)反应③的化学方程式。
(3)下列物质中不能与溴水发生反应的是
①乙烯②亚硫酸③NaOH溶液④AgNO3溶液⑤裂化汽油⑥甲烷⑦FeCl2溶液
| A.③④⑥ | B.①⑦ | C.⑥ | D.②⑤ |
(4)现有下列物质
互为同系物的有(填序号,下同),互为同分异构体的有,已知15g乙烷完全燃烧生成液态水放出akJ的热量,请写出乙烷完全燃烧的热化学方程式:
氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: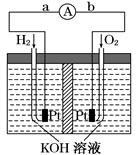
(1)氢氧燃料电池的能量转化主要形式是,在导线中电流流动方向为(用a、b表示),
(2)负极的电极反应式为,
(3)关于该电池的说法错误的是
| A.氢气在负极发生氧化反应 |
| B.供电时的总反应为:2H2+O2=2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |
(4)在下图所示的装置中,能够发生原电池反应的是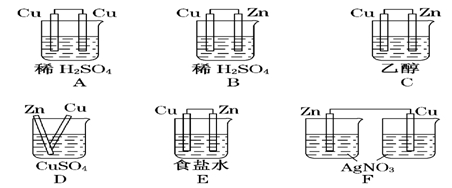
(5)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a附近滴加一滴石蕊试液,现象是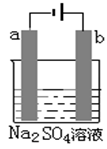
。
( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题: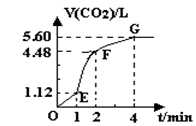
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是(填字母)。
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)加入CaCO3的质量为。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率V(HCl)==。
有效地利用现有新能源和开发新能源已受到各国的重视。
(1)工业上可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入CH30C(CH3)3,来生产无铅汽油”。 H3COC(CH3)3分子必存在的原子间连接形式有。(填写编号,多选不得分)
①>C=0 ②>C=C< ③ ④
④
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是甲烷。能说明它是正四面体而非正方形平面结构的理由是。(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济的制氢方法是
①电解水 ②锌和稀硫酸反应 ③光解海水
(4)其次,制得纯氢气后,还需要解决的问题是。(写出其中的一个)