已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 |
HF |
HClO |
H2CO3 |
| 电离平衡常数 |
6.8×10-4 |
4.7×10-8 |
K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是
A.常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小
B.若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+
C.往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小
D.同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子可能是 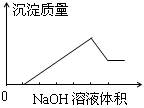
| A.Mg2+、Al3+、Fe3+ | B.Na+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.H+、Mg2+、Al3+ |
在无色溶液中,下列离子能大量共存的是
| A.Na+、NH4+ 、NO3-、MnO4- | B.K +、SO42-、OH-、AlO2- |
| C.K +、Fe3+ 、Cl-、Br- | D.Ba2+ 、Na+ 、OH-、CO32- |
海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气②将海带烧成灰,向灰中加水搅拌③加入CCl4振荡④过滤⑤用分液漏斗分液。合理的操作顺序( )
| A.②一④一①一③一⑤ | B.②一①一③一④一⑤ |
| C.①一③一⑤一②一④ | D.③一①一②一⑤一④ |
用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是
| A.将5.85gNaCl固体溶于1 L水中可配成0.1 mol·L-1的NaCl溶液 |
| B.称量时,将固体NaCl直接放在天平左盘上 |
| C.固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线 |
| D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
下列说法正确的是
| A.硅材料广泛应用于光纤通讯 |
| B.工艺师利用盐酸刻蚀石英制作工艺品 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐产品 |
| D.粗硅制备单晶硅不涉及氧化还原反应 |