下列是一个化工生产过程的设计框图: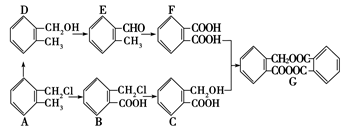
根据要求回答下列各题(填对应字母)。
(1)只含有一种官能团的物质是________。
(2)含有羧基的是________。
(3)写出G物质的分子式________。
选择合适的药品,把下列物质中含有的少量杂质(括号内为杂质)除去,写出所需的药品和有关的离子方程式。
| 物质(杂质) |
除杂药品 |
离子方程式 |
| NaHCO3溶液(Na2CO3) |
||
| CO2(HCl) |
||
| FeCl2溶液(FeCl3) |
||
| FeCl3溶液(FeCl2) |
自然界中的物质多数是以混合物的形式存在,对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①提取碘水中的碘,用_____________方法。
②除去食盐溶液中的水,可采用_____________的方法。
③氧化铜中含有铜绿[主要成分为碱式碳酸铜Cu2(OH)2CO3]可用________的方法
写出符合以下离子方程式的化学方程式各1个
(1)Zn+Cu2+=Zn2++Cu
(2)H++OH-=H2O
在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH+H2↑; |
| C.CaO+H2O=Ca(OH)2; | D.2H2O=2H2↑+O2↑。 |
其中水是氧化剂的是___________,水是还原剂的是_____________,水既是氧化剂,又是还原剂的是____________,水既不是氧化剂,又不是还原剂的是________________。(填序号)
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,是氧化剂;是氧化产物;