观察下列结构简式,回答下列问题:
Ⅰ、乙酸的结构简式为
(1)a的名称是__________。
(2)c的名称是________________。
Ⅱ、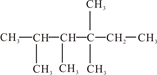
(1)有机物名称是__________________________。
(2)此有机物为烯烃加成的产物,则原来烯烃的结构可能有_______种。
写出298 K时,下列反应的热化学方程式:
(1)1mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ。____________________________________
(2)在稀溶液中1 mol H2SO4与足量NaOH反应放热114.6 kJ,表示该中和热的热化学方程式为
(3)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为,表示H2燃烧热的热化学方程式为_
(4)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知N2 (g) + 2O2 (g) =2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g) =N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4 (g)和二氧化氮反应的热化学方程式为
(14分)T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.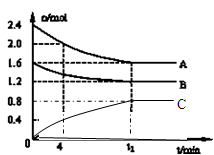
(1)写出该反应的方程式:_____
(2)计算该温度下该反应的平衡常数:______
(3)若升温A的量增加,则该反应是______热反应.
(4)0~4分钟时,C的平均反应速率为:______
(5)到达平衡时A的转化率为:______
(6)恒容条件下,下列措施中能使n(A)/n(C)减小的有______.
A.充入氦气
B.使用催化剂
C.再充入2.4molA和1.6molB
D.降低温度
(7) 后的某一时刻后,加压,平衡左移,造成这一结果的原因可能是
后的某一时刻后,加压,平衡左移,造成这一结果的原因可能是
(10分)(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________ 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________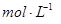 。
。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入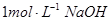 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。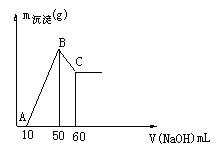
①合金中镁的质量g。
②盐酸的物质的量浓度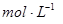 。
。
(10分) A、B、C是单质,其中A是金属,各种物质间的转化关系如图: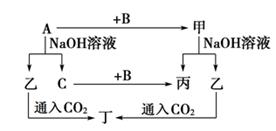
根据图示转化关系回答:
(1)A与NaOH溶液反应的化学方程式________________________________。该反应中的氧化剂是。(填填化学式)
(2)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为6.72 L,则消耗的A的物质的量为________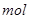 ,转移电子的物质的量为________
,转移电子的物质的量为________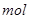 。
。
(3)乙溶液中通入少量CO2反应的离子方程式__________________________。
(10分)已知砒霜As2O3与Zn可以发生如下反应:
As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
(1)请用双线桥法标出电子转移的方向和数目。_____________________________。
(2)As2O3在上述反应中显示出来的性质是____________________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为_____________________。