按要求回答下列问题:
(1) 的系统命名为 ;
的系统命名为 ;
(2)3甲基2戊烯的结构简式为 ;
(3) 的分子式为 ;
的分子式为 ;
(4)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①试写出它的一种链式结构的同分异构体的结构简式_______________________。
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为________________________形。
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O22H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。则下列推断中,正确的是()
| A.正极反应为4OH—→2H2O+O2↑+4e- | B.当电池生成1mol水时,转移4mol电子 |
| C.放电时CO32-向负极移动 | D.通H2的一极为负极,发生还原反应 |
其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B(g)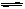 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)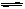 B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)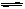 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)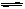 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是:
2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是: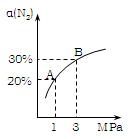
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) <K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
对于工业制硫酸中接触室内的反应:2SO2(g)+O2 (g) 2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
| A.升高温度 | B.恒温、恒容充入氧气 |
| C.恒温恒容充入SO3 | D.加入催化剂V2O5 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |