已知酸性: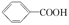 >H2CO3>
>H2CO3>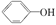 ,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将
,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将 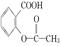 转变为
转变为 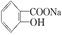 的最佳方法是( )
的最佳方法是( )
| A.与稀H2SO4共热后,加入足量的NaOH溶液 |
| B.与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA |
| C.标准状况下,22.4 LNO2和NO的混合气体中所含的氮原子总数为2NA |
| D.将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |
常温下,向l00mL 0.01 mol•L-1盐酸中逐滴加入0.02 mol•L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是()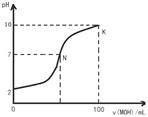
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值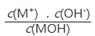 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol•L-1 |
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是()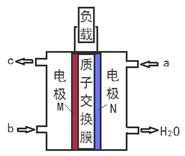
| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
在密闭容器中进行反应:X(g)+3Y(g)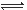 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )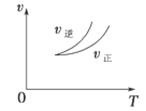

| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
对于相应化学用语的推论合理的是()
| 选项 |
化学用语 |
推论 |
| A |
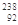 U3+ U3+ |
该铀离子核外有89个电子 |
| B |
2H2(g)+O2(g)=" " 2H2O(g);△H=-483.6kJ•mol |
1mol氢气完全燃烧放出热量483.6kJ. |
| C |
2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
NaCl氧化性比Cl2强 |
| D |
FeO+4H++NO3―= Fe3++NO2↑+2H2O |
氧化亚铁溶于稀硝酸的离子方程式 |