该小组同学设计了甲、乙两套实验装置,对甲酸与甲醇进行了酯化反应的研究:

(1)装置乙中长导管的作用是 。
(2)甲酸和甲醇(CH318OH)进行酯化反应的化学方程式 。
(3)甲装置还是乙装置好? ,其原因是 。
(4)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有 、 两种必备用品。
(5)某同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释: 。
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。
已知乙醛在加热条件下能与新制Cu(OH)2反应生成Cu2O。
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)(加热和夹持装置已略去).
(2)B装置中发生的化学方程式.
(3)F装置中的固体试剂是,发生反应的化学方程式为.
反应一断时间后移去酒精灯,反应能继续进行,其原因是.
(4)A装置和D装置中的实验现象分别为.
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见.
实验室中用甲醇、水、空气和铜粉制取甲醛溶液。下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生置不同,分别如甲和乙所示。请回答下列问题: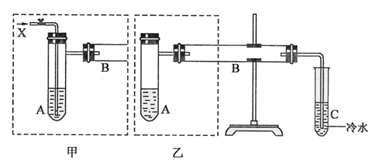
(1)在仪器组装完成后,加装试剂前必须要进行的操作是;
(2)若按甲装置进行实验,则通入A的X是,B中发生反应的化学方程式为;
(3)若按乙装置进行实验,则B管中应装入的物质是,B中发生反应的化学方程式为;
(4)两套装置中都需要加热的仪器有(选填A、B、C);
(5)设计实验,检验实验后C中所得液体确为甲醛溶液:。
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。为了测定RX的分子量,实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀。
④过滤、洗涤、干燥后称重,得到固体c g。回答下面问题:
(1)装置中长玻璃管的作用是_______________________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的____________离子。
(3)该卤代烷中所含卤素的名称是_________,判断的依据是____________。
(4)该卤代烷的分子量是_________(用含a、b、c的式子表示)。
(5)在步骤②中,如果加HNO3的量不足,则步骤④中测得的c值______。
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
(14分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接,接,B接,接。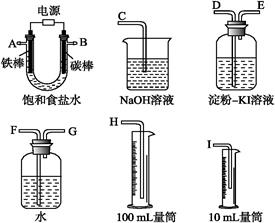
(2)铁棒接直流电源的极;碳棒上发生的电极反应为。
(3)能说明氯气具有氧化性的实验现象是。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气换算成标准状况下为5.6 mL时,溶液的pH为。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水CaCl2和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质最是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。