电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。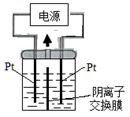
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
| A.右侧发生的电极方程式:2H2O+2e—=H2↑+2OH— |
| B.电解结束时,右侧溶液中含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
| A.0~3 min内,v(CO2)正 =v (CH3OH)正 |
| B.其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 |
| C.在T1℃时,若起始时向容器中充入2molCO2和6mol H2 , 测得平衡时容器内压强为P2, 则 P2<2P1 |
| D.T2℃时,上述反应平衡常数为4.2,则T2>T1 |
下列说法中正确的是
A.25℃时,pH=7的CH3COOH与CH3COONa的混合液中离子浓度的大小顺序为:
c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
B.25℃时,0.1mol/L NaHA溶液pH=3,该溶液中某些微粒的浓度大小顺序为:
c(HA-)>c(H+)>c(H2A)>c(A2-)
C.25℃时,若10mL pH=a的盐酸与100mL pH=b 的Ba(OH)2溶液混合后恰好中和,则a+b=13
D.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
下列关系图中,A是一种正盐,B为气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下图所示的转化关系(其它反应产物和所需条件均已略去)。则下列说法中不正确的是
| A.当X是强酸时,A~F均含同一种元素,F可能为H2SO4 |
| B.当X是强碱时,A~F均含同一种元素,F可能为HNO3 |
| C.B和Cl2的反应为氧化还原反应 |
| D.当X是强酸时,常温下C为气态单质 |
根据实验目的判断下列实验操作或装置正确的是 
下列离子方程式正确的是
| A.水玻璃长时间放置在空气中:SiO32-+CO2+H2O=H2SiO3↓+HCO3- |
| B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ |
C.用石墨电极电解饱和食盐水:2H++2Cl-  H2↑+Cl2↑ H2↑+Cl2↑ |
| D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: |
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O